Biología Celular 07: Microtúbulos y División Celular
Estos son los apuntes de la clase 7 del curso de Biología Celular de Harvard Extension.
La clase 6 introdujo los microtúbulos, y esta clase tratará su papel en la división celular. Aquí hay un vídeo introductorio:
Resumen del ciclo celular
El ciclo celular -el proceso de división y replicación celular- está gobernado por una serie de interruptores bioquímicos llamados sistema de control del ciclo celular.
El ciclo celular está dividido en fases que se dividen en fases -la gente se referirá a las «4 fases» pero en realidad son 5, y la gente también utiliza otras palabras para agrupar esas fases, y otras palabras para subdividirlas. He intentado resumir la relación entre estos términos en la siguiente tabla. (modificado/ampliado de Wikipedia):
| Agrupación más general | las supuestas «4 fases» | subfases | nodividiendo | Gap 0 (G0) |
|---|---|---|
| interfase | Gap 1 (G1) | G1a R G1b |
| Síntesis (S) | ||
| Gap 2 (G2) | ||
| Mitosis | Mitosis (M) | profase prometafase metafase anafase telofase citocinesis |
El contenido de cada fase está bellamente resumido en esta destacada imagen de Wikimedia Commons por Kelvinsong:

Las células humanas de más rápida división pueden completar un ciclo celular en unas 24 horas (G1: 9h, S: 10h, G2: 4h, M: 30 min). La levadura puede terminar un ciclo en 30 minutos, y las células de Drosophila que se dividen más rápidamente tardan tan sólo 8 minutos.
Los controladores principales de este proceso incluyen las ciclinas, que regulan la quinasa dependiente de ciclina o CDK. Recordemos que las quinasas son proteínas que fosforilan otras proteínas. La fosforilación de sus objetivos por parte de la CDK permite que la mitosis continúe. En concreto, el factor promotor de la maduración o MPF es un complejo heterodimérico obligado compuesto por ciclina B y CDK, que sólo realiza su acción fosforiladora cuando ambas proteínas están presentes.
Función de los microtúbulos
Los microtúbulos son fundamentales a lo largo del ciclo celular: organizan los componentes celulares y los dividen en dos. Aquí hay una serie de vídeos del ciclo celular que destacan el papel de los microtúbulos:
En los animales, las células quiescentes e incluso las células en interfase suelen tener un solo MTOC, llamado centrosoma, que sirve como eje central para todos los microtúbulos de la célula. Un centrosoma está compuesto por dos centríolos como se muestra a continuación (gracias de nuevo a Kelvinsong):

Los dos centríolos se desprenden el uno del otro y se replican durante la fase S, y luego se separan para formar «polos» opuestos de la célula durante la fase M, de modo que ahora hay dos MTOC, cada uno de los cuales será finalmente el único MTOC de una nueva célula (otra imagen del jefe Kelvinsong):
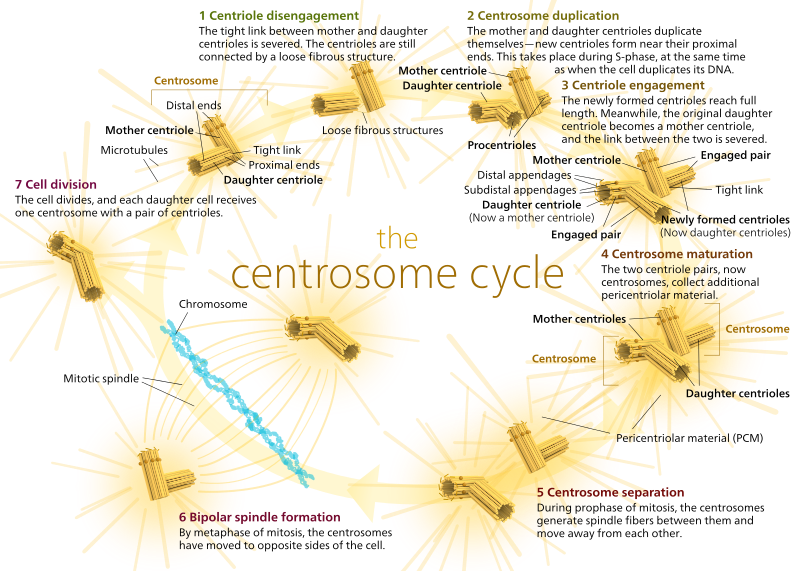
Durante la mitosis, entonces, tienes los dos «polos» de la célula, cada uno con microtúbulos anclados en el extremo (-) y con sus extremos (+) superpuestos, apuntando al centro de la célula, como se muestra aquí (imagen de Wikimedia Commons por Lordjuppiter):
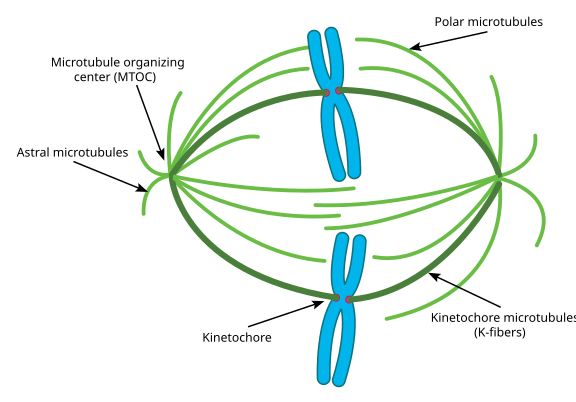
Todo eso se llama aparato del huso, y la zona en la que se superponen los microtúbulos de los dos MTOC se llama «zona de interdigitación». A veces oirás que cada MTOC y su conjunto de microtúbulos en forma de erizo se llama ‘aster mitótico’
Se dice que los microtúbulos durante esta etapa se dividen en tres categorías:
- Los microtúbulos astrales apuntan hacia fuera, hacia la corteza celular, para anclar todo el aparato del huso a lo largo del eje de la división celular.
- Los microtúbulos del cinetocoro se unen al cinetocoro de las cromátidas.
- Los microtúbulos polares, orientados en paralelo pero en direcciones opuestas, son cruciales para empujar el aparato del huso durante la mitosis. (De hecho, los microtúbulos polares también están presentes antes y ayudan a separar los centrosomas durante la profase).
Si prefieres fotos en lugar de diagramas, aquí tienes el aspecto de todo el aparato del huso, con las cromátidas en azul, los microtúbulos en verde y los cinetocoros como puntos rojos:

Los microtúbulos se vuelven mucho más dinámicos durante la mitosis: más gamma-tubulina promueve una nucleación más fácil, pero XMAP215, un estabilizador de microtúbulos, se fosforila y por lo tanto se inactiva durante la mitosis, dejando a Kinesin-13 libre para catastrofizar los microtúbulos. Las fortunas se hacen y se pierden rápidamente. La vida media de un microtúbulo durante la mitosis es de unos 15 minutos, frente a los 30 minutos de la interfase. La gente estudia la dinámica de los microtúbulos utilizando FRAP: se añade un microtúbulo fluorescente, se blanquea y se observa la rapidez con la que se produce el reensamblaje en función de la rapidez con la que reaparece la fluorescencia. +Las puntas también juegan un papel importante en la ayuda y el ensamblaje de los microtúbulos.
Kinesina-5 tiene dos cabezas polares que se unen a microtúbulos opuestos y tratan de caminar hacia el extremo (+) de cada uno. Esto empuja a los dos microtúbulos y proporciona la fuerza motriz para la separación de los MTOCs.
El ADN centromérico tiene una baja entropía de la información e histonas especiales que difieren del resto de la cromatina. Los centrómeros son una parte del genoma que casi nunca se recoge en la secuenciación de próxima generación, incluso a una profundidad realmente alta. Esto se debe a que los centrómeros tienen una función diferente a la de gran parte del resto del genoma: la secuencia allí es favorable para la interacción con las proteínas centroméricas y la fijación del cinetocoro. Las cohesinas son proteínas que mantienen unidas las dos cromátidas hermanas. Nos referiremos a las proteínas del cinetocoro como si tuvieran dos capas, el cinetocoro interno y el cinetocoro externo.
Durante la prometafase, los cromosomas se mueven hacia delante y hacia atrás. Las kinesinas anclan los cromosomas a los microtúbulos del cinetocoro más allá de la punta, donde la kinesina-13 está despolimerizando los microtúbulos, ayudada por la escasez de dímeros de tubulina disponibles. Una combinación de proteínas motoras, proteínas que interactúan con los microtúbulos y treadmilling sirve para mover los cromosomas. Mientras tanto, la dineína y la dinactina -proteínas motoras que caminan hacia el extremo (-)- trabajan sobre los microtúbulos astrales, tirando de los MTOC hacia la periferia celular. En metafase, las cromátidas llegan a alinearse a lo largo de la «placa de metafase».
Durante este proceso, la envoltura nuclear se disuelve y, por tanto, la importación nuclear se vuelve irrelevante. El Ran-GEF se localiza cerca de los cromosomas y genera altas concentraciones de Ran-GTP que proporciona energía para algunos procesos necesarios (…).
Las células tienen algún mecanismo para detectar la tensión en los microtúbulos que indica sus cromátidas de unión antes de que la mitosis pueda proceder. Asegurarse de que cada cromátida está bien anclada es crucial para evitar la aneuploidía.
Por cierto, otros elementos del citoesqueleto además de los microtúbulos también juegan un papel clave en el ciclo celular. En la citocinesis, la actina forma un anillo contráctil y, con la ayuda de las proteínas motoras de la miosina II, cincha la célula en dos.
Importancia de los organismos modelo
El descubrimiento de los procesos reguladores del ciclo celular se apoyó en gran medida en algunas características prolijas de populares organismos modelo.
Saccharomyces cerevisiae (levadura en ciernes) y Schizosaccharomyces pombe (levadura de fisión) pueden existir como haploides o diploides. Esto es importante porque en la fase haploide, una mutación puede eliminar un gen, no es necesario que se den los dos alelos. Y en la levadura, muchas mutaciones, especialmente en los genes Cdc__ (control de la división celular), dependen de la temperatura, donde una proteína con una mutación sin sentido puede seguir funcionando correctamente a temperaturas «permisivas», pero pierde su función nativa a temperaturas «no permisivas». Esto permite estudiar el fenotipo knockout (a la temperatura no permisiva) y al mismo tiempo tener la comodidad de poder propagar fácilmente los organismos (a la temperatura permisiva). Todo el genoma de S. cerevisiae está disponible en forma de bibliotecas de plásmidos, lo que hace posible examinar qué plásmido rescata el fenotipo de un determinado mutante. Así es como se descubrieron muchos de los genes que regulan el ciclo celular.
En S. cerivisiae, la gemación forma parte de la fase G1, y una vez que la célula hija alcanza un determinado tamaño, en un momento llamado «START», las dos se comprometen a entrar en S y, finalmente, a completar el ciclo celular. Las células de los mamíferos tienen su propio punto de compromiso llamado punto de restricción o R, en G1, que es análogo al START.
Los mutantes Cdc28 sensibles a la temperatura no brotan a la temperatura no permisiva. El gen Cdc28 codifica el homólogo de la levadura de nuestra quinasa dependiente de ciclina (CDK) que, cuando y sólo cuando está en complejo con la ciclina, puede fosforilar otras proteínas para regular su participación en las fases del ciclo celular. Los mutantes sensibles a la temperatura, a la temperatura no permisiva, se atascan sin poder brotar y entrar en la fase S. En su lugar, se comportan como las células de tipo salvaje privadas de nutrientes: crecen lo suficiente como para pasar el START pero luego no continúan.
El xenopus (una especie de rana) resultó ser crítico para entender el ciclo celular, porque su reproducción implica un número muy grande de células (es decir, suficiente material de partida para los Western blots, etc.) que están perfectamente sincronizadas (es decir, todas están en la misma fase del ciclo celular en el mismo momento. (Compárese con la levadura, por ejemplo, donde las células no estarán todas en la misma fase al mismo tiempo). Además, el propio huevo es grande y fácil de trabajar, y a la fecundación le siguen múltiples ciclos celulares. En las ranas, los óvulos comienzan la división meiótica pero luego se detienen en la fase G2 durante 8 meses mientras crecen en tamaño y almacenan cosas que serán necesarias para el crecimiento tras la fertilización.
Filamentos intermedios
Además de los microfilamentos y los microtúbulos, las células eucariotas también tienen una serie de «otras» proteínas del citoesqueleto llamadas filamentos intermedios (FI). Aunque son más diversos que los microfilamentos y los microtúbulos, los FI no son un término que englobe a «cualquier otro filamento», sino que son un grupo de proteínas relacionadas. En general, se extienden por el citoplasma y la envoltura nuclear interna, no son polares y no tienen proteínas motoras asociadas. Tienen una gran resistencia a la tracción y son muy estables, con una tasa de intercambio lenta y sin mucha descomposición, aunque la fosforilación puede promover su desensamblaje. Estos son algunos ejemplos populares:
- Las queratinas se encuentran en las células epiteliales, las células del mesodermo y las neuronas. Proporcionan fuerza y vienen en formas ácidas y básicas. Cada una de ellas puede formar su propia hebra, pero la mayoría de las IF están formadas por dos hebras, una básica y otra ácida, como retorcidas una alrededor de la otra. El cabello y las uñas están formados por queratina «dura», rica en cisteína para los enlaces disulfuro, que proporciona la inmensa fuerza. Las permanentes y los alisados se basan en la reducción de los enlaces disulfuro, en la remodelación del cabello y en la reformación de los enlaces disulfuro. También hay queratina «blanda» en la piel.
- Las desminas, como la vimentina, se encuentran en las células mesenquimales (hueso, cartílago y grasa).
- Los neurofilamentos se encuentran en los axones neuronales y regulan su diámetro, lo que a su vez determina la velocidad de propagación del potencial de acción.
- Las lamininas son las más extendidas y se cree que son las más similares al ancestro filogenético de todos los demás FI. Proporcionan soporte estructural a la membrana nuclear. Podrían ayudar a espaciar los complejos de poros nucleares y también a organizar el ADN.
Por último, un vídeo resumen: