Biología práctica
Práctica o demostración en clase
El peróxido de hidrógeno (H2O2) es un subproducto de la respiración y se produce en todas las células vivas. El peróxido de hidrógeno es perjudicial y debe eliminarse en cuanto se produce en la célula. Las células fabrican la enzima catalasa para eliminar el peróxido de hidrógeno.
En esta investigación se observa la tasa de producción de oxígeno por la catalasa en un puré de patata al variar la concentración de peróxido de hidrógeno. Se recoge el oxígeno producido en 30 segundos sobre el agua. Luego se calcula la velocidad de reacción.
Organización de la lección
Puede realizar esta investigación como una demostración a dos concentraciones diferentes, o con grupos de estudiantes que trabajen cada uno con una concentración diferente de peróxido de hidrógeno. Los estudiantes individuales pueden tener tiempo para recoger datos repetidos. Los grupos de tres podrían trabajar para recoger los resultados de 5 concentraciones diferentes y rotar los papeles de manipulador del aparato, lector de resultados y escribiente. Cotejar y comparar los resultados de la clase permite a los estudiantes buscar datos anómalos e incoherentes.
Aparatos y productos químicos
Canaleta neumática/ cubeta de plástico/ acceso a pileta adecuada de agua
Matraz cónico, 100 cm3, 2
Jeringa (2 cm3) para encajar en el segundo orificio del tapón de goma, 1
Cilindro de medida, 100 cm3, 1
Cilindro de medición, 50 cm3, 1
Soporte de pinza, jefe y abrazadera, 2
Reloj de parada/ cronómetro
Para la clase – montado por el técnico/profesor:
Peróxido de hidrógeno, rango de concentraciones, 10 vol, 15 vol, 20 vol, 25 vol y 30 vol, 2 cm3 por grupo de cada concentración (Nota 1)
Patata purificada, fresca, en vaso de precipitados con jeringa para medir al menos 20 cm3, 20 cm3 por grupo por concentración de peróxido investigada (Nota 2)
Tapón de goma, de 2 agujeros, para encajar en matraces cónicos de 100 cm3 – tubo de salida en un agujero (conectado a un tubo de goma de 50 cm)
Utilizar protección para los ojos y cubrir la ropa al manipular peróxido de hidrógeno.
Lavar inmediatamente las salpicaduras de puré de patata o de peróxido de la piel.
Tener en cuenta el aumento de la presión si se obstruyen los recipientes de reacción.
Tener cuidado al insertar el tapón en el matraz cónico – tiene que quedar bien ajustado, así que empujar y girar el tapón con cuidado.
1 Peróxido de hidrógeno: (Véase la ficha de riesgo de CLEAPSS) Las soluciones de menos de 18 vol son de BAJO RIESGO. Las soluciones a concentraciones de 18-28 vol son IRRITANTES. Tenga cuidado al retirar el tapón del frasco de reactivo, ya que puede haberse acumulado presión de gas en su interior. Diluir inmediatamente antes de usar y poner en una botella marrón limpia, porque la dilución también diluye el inhibidor de la descomposición. Conservar en botellas marrones porque el peróxido de hidrógeno se degrada más rápidamente a la luz. Desechar toda la solución no utilizada. No devuelva la solución a las botellas de reserva, porque los contaminantes pueden causar descomposición y la botella de reserva puede explotar después de un tiempo.
2 El puré de patata puede irritar la piel de algunas personas. Haga uno nuevo para cada lección, porque la actividad de la catalasa se reduce notablemente en 2/3 horas. Puede ser necesario añadir agua para hacerlo menos viscoso y más fácil de usar. Los discos de patata reaccionan muy lentamente.
3 Si las burbujas del tubo de goma son demasiado grandes, introduce una pipeta de vidrio o un tubo de vidrio en el extremo del tubo de goma.
Procedimiento
SEGURIDAD: Usar protección para los ojos y proteger la ropa del peróxido de hidrógeno. Aclare las salpicaduras de peróxido y de puré de patata de la piel lo más rápidamente posible.
Preparación
a Prepare suficiente peróxido de hidrógeno diluido justo antes de la lección. Colócalo en botellas marrones (Nota 1).
b Prepara el puré de patata fresco para cada lección (Nota 2).
c Prepara tapones de 2 agujeros como se describe en la lista de aparatos y en el diagrama.
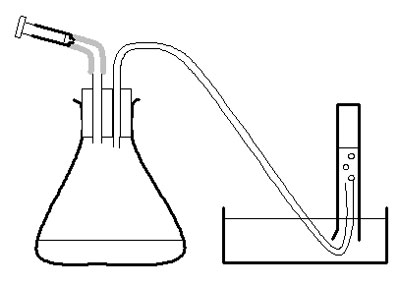
Investigación
d Utiliza la jeringa grande para medir 20 cm3 de puré de patata en el matraz cónico.
e Coloca el tapón de forma segura en el matraz – gira y empuja con cuidado.
f Llena hasta la mitad la cubeta, cuenco o fregadero con agua.
g Llena la probeta de 50 cm3 con agua. Invierta la probeta sobre la cubeta de agua, con el extremo abierto por debajo de la superficie del agua en el cuenco, y con el extremo del tubo de goma en la probeta. Sujétalo en su sitio.
h Mide 2 cm3 de peróxido de hidrógeno en la jeringa de 2 cm3. Coloca la jeringa en su lugar en el tapón del matraz, pero no empujes el émbolo directamente.
i Comprueba que el tubo de goma está de forma segura en la probeta. Empujar el émbolo de la jeringa y poner en marcha inmediatamente el cronómetro.
j Después de 30 segundos, anotar el volumen de oxígeno en la probeta en una tabla de resultados adecuada. (Nota 3.)
k Vaciar y enjuagar el matraz cónico. Medir en él otros 20 cm3 de puré de patata. Vuelve a montar el aparato, rellena la probeta y repite de g a j con otra concentración de peróxido de hidrógeno. Utiliza una probeta de 100 cm3 para concentraciones de peróxido de hidrógeno superiores a 20 vol.
l Calcula la tasa de producción de oxígeno en cm3/s.
m Traza una gráfica de la tasa de producción de oxígeno frente a la concentración de peróxido de hidrógeno.
Notas didácticas
Ten en cuenta las unidades para medir la concentración de peróxido de hidrógeno – no son unidades del SI. El peróxido de hidrógeno de 10 vol producirá 10 cm3 de oxígeno por cada cm3 que se descomponga.(Nota 1.)
En este procedimiento, 2 cm3 de peróxido de hidrógeno de 10 vol liberarán 20 cm3 de oxígeno si la reacción se completa. Se añaden 2 cm3 de líquido al matraz cada vez. Por lo tanto, si el aparato no tiene fugas, se deben desplazar 22 cm3 de agua en la probeta con peróxido de hidrógeno de 10 vol. El oxígeno es soluble en agua, pero sólo se disuelve lentamente en ella a temperaturas ambiente normales.
Utiliza esta información como comprobación del montaje práctico. Los valores inferiores a 22 cm3 muestran que el oxígeno se ha escapado, o que el peróxido de hidrógeno no ha reaccionado completamente, o que la concentración de peróxido de hidrógeno no es la esperada. Pida a los alumnos que expliquen cómo pueden producirse valores superiores a 22 cm3.
Un error de ± 0,05 cm3 en la medición de 30 vol de peróxido de hidrógeno podría suponer un error de ± 1,5 cm3 en la producción de oxígeno.
El hígado también contiene catalasa, pero la manipulación de despojos es más controvertida entre los alumnos e introduce un mayor riesgo higiénico. Además, la reacción es tan vigorosa que las burbujas de la mezcla pueden arrastrar trozos de hígado al tubo de suministro.
Si recoger el gas sobre el agua es complicado, y tiene acceso a una jeringa de gas de 100 cm3, podría recoger el gas en eso en su lugar. Asegúrese de sujetar la jeringa de gas de forma segura pero con cuidado.
La reacción es exotérmica. Los alumnos pueden notar el calor si ponen sus manos en el matraz cónico. ¿Cómo afectará esto a los resultados?
Salud y seguridad comprobadas, septiembre de 2008
Descargas
Descarga la hoja del alumno ![]() Investigando una reacción controlada por enzimas: catalasa y concentración de peróxido de hidrógeno (67 KB) con preguntas y respuestas
Investigando una reacción controlada por enzimas: catalasa y concentración de peróxido de hidrógeno (67 KB) con preguntas y respuestas