Blog de Proteómica Creativa
El Western Blot fue introducido por Towbin et al. en 1979, y es un método comúnmente utilizado para el análisis de proteínas. Puede utilizarse para el análisis cualitativo y semicuantitativo de proteínas. Para la realización del western blot, existen tres elementos, la separación de proteínas por tamaño, la transferencia de proteínas a un soporte sólido, y el marcaje de proteínas mediante anticuerpos primarios y secundarios para su visualización.
Principio del Western Blot
El western blot se realiza mediante electroforesis en gel de polipropileno. El SDS-PAGE permite separar las muestras de proteínas y transferirlas a un soporte sólido, como una membrana de nitrocelulosa (NC) o de difluoruro de polivinilideno (PVDF). El soporte sólido puede absorber la proteína y mantener su actividad biológica sin cambios. La membrana de soporte sólido transferida se denomina blot y se trata con una solución proteica para bloquear el sitio de unión hidrofóbica en la membrana. La membrana se trata con el anticuerpo (anticuerpo primario) de las proteínas objetivo. Sólo las proteínas a estudiar pueden unirse específicamente al anticuerpo primario para formar un complejo antígeno-anticuerpo. Después de lavar y eliminar el anticuerpo primario, sólo la posición de la proteína objetivo se une al anticuerpo primario. Las membranas tratadas con el anticuerpo primario se tratan con un anticuerpo secundario marcado después del lavado. Después del tratamiento, el anticuerpo secundario marcado que se une al anticuerpo primario forma un complejo de anticuerpos que puede indicar la ubicación del anticuerpo primario, tanto la ubicación de la proteína que se está estudiando.
El procedimiento de Western Blot
Hay seis pasos involucrados en Western Blot, incluyendo la preparación de la muestra, la electroforesis en gel, la transferencia de proteínas, el bloqueo, la incubación de anticuerpos y la detección y visualización de proteínas.
1. Las proteínas pueden extraerse de diferentes muestras, como tejidos o células. Dado que las muestras de tejidos presentan un mayor grado de estructura, los tejidos se descomponen primero mediante la invención mecánica, como el homogeneizador o la sonicación. Se suelen utilizar inhibidores de proteasas y fosfatasas para evitar la digestión de la muestra a bajas temperaturas. Después de la extracción de proteínas, es importante detectar la concentración de proteínas, lo que permite conocer la masa de proteínas cargada en cada pocillo. Y para la concentración de proteínas se suele utilizar un espectrofotómetro.
2. Electroforesis en gel.

El gel más utilizado es el de poliacrilamida (PAG) y los tampones cargados con dodecil sulfato sódico (SDS). El Western blot utiliza dos tipos de gel de agarosa: el gel de apilamiento que se utiliza para concentrar todas las proteínas en una banda y el gel de separación que permite separar las proteínas según su peso molecular. Las proteínas más pequeñas migran más rápidamente en SDS-PAGE cuando se aplica un voltaje. El PAGE puede separar proteínas que van de 5 a 2.000 kDa según el tamaño uniforme del poro, que se controla mediante la diferente concentración de PAG. Típicamente los geles de separación se hacen en 5%, 8%, 10%, 12% o 15%. A la hora de elegir el porcentaje adecuado del gel de separación, debemos tener en cuenta el tamaño de las proteínas objetivo. Cuanto menor sea el peso conocido de las proteínas, mayor será el porcentaje de los geles que debemos utilizar.
3. Transferencia de proteínas.
Después de separar las proteínas por electroforesis en gel, las proteínas se trasladan desde el interior del gel a una membrana de soporte sólido para que las proteínas sean accesibles a la detección de anticuerpos. El principal método para transferir las proteínas se denomina electroblotting, que utiliza un campo eléctrico orientado perpendicularmente a la superficie del gel, para sacar las proteínas del gel y trasladarlas a la membrana. Puede realizarse en condiciones semisecas o húmedas, mientras que las condiciones húmedas suelen ser más fiables, ya que es menos probable que el gel se seque. Como se muestra en la figura de la izquierda, la membrana se coloca entre la superficie del gel y el filtro. El sándwich de transferencia se crea de la siguiente manera: una almohadilla de fibra (esponja), papeles de filtro, el gel, una membrana, papeles de filtro, una almohadilla de fibra (esponja).
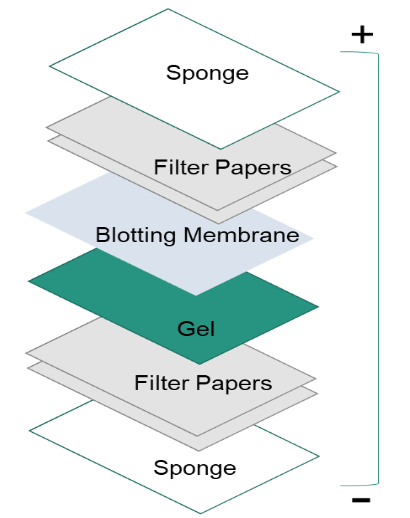 4. Bloqueo.
4. Bloqueo.
El bloqueo es un paso importante en el western blot para evitar que los anticuerpos se unan a la membrana de forma no específica. Los bloqueadores típicos más utilizados son el BSA y la leche seca no grasa. Cuando la membrana se coloca en la solución diluida de proteínas, éstas se adhieren a todos los lugares de la membrana donde las proteínas objetivo no se han unido. De este modo, el «ruido» en el producto final del western blot puede reducirse y dar lugar a resultados más claros.
5. Incubación del anticuerpo.
Después del bloqueo, el anticuerpo primario se une a la proteína diana cuando el anticuerpo primario se incuba con la membrana. La elección de un anticuerpo primario depende del antígeno a detectar. El lavado de la membrana con la solución tampón de anticuerpos es útil para minimizar el fondo y elimina los anticuerpos no unidos. Tras el lavado de la membrana, ésta se expone al anticuerpo secundario específico conjugado con enzimas. Al realizar la incubación del anticuerpo secundario, el anticuerpo secundario marcado puede unirse al anticuerpo primario que ha reaccionado con las proteínas objetivo. En función de la especie del anticuerpo primario, podemos elegir el anticuerpo secundario adecuado.
6. Detección y visualización de proteínas.
Un sustrato reacciona con la enzima que está unida al anticuerpo secundario para generar una sustancia coloreada. Nos permite conocer la densitometría y la localización de la proteína objetivo. Y las aproximaciones de tamaño se toman comparando las bandas de proteínas con el marcador. Hay varios sistemas de detección disponibles para la visualización de proteínas, como la detección colorimétrica, la detección quimioluminiscente, la detección radiactiva y la detección fluorescente. El sistema de electroquimioluminiscencia (ECL) es el método de detección más común.
El western blot se utiliza habitualmente para la detección cualitativa de proteínas y modificaciones postraduccionales (por ejemplo, fosforilación). Además, también puede utilizarse en diagnósticos médicos, como la prueba del VIH o la prueba de la EEB.