El mecanismo del aumento de la inotropía (fuerza de contracción del corazón) de la digoxina (Lanoxin)
La digoxina (Lanoxin) es un glucósido cardíaco bien conocido y se ha utilizado durante muchos años para tratar varios problemas cardiovasculares, como la insuficiencia cardíaca y el control de la frecuencia en pacientes con arritmias auriculares que experimentan una respuesta ventricular rápida.1,2 En lo que respecta a la insuficiencia cardíaca, es importante señalar que se trata de un contexto de insuficiencia cardíaca sistólica, y no de insuficiencia cardíaca diastólica, en la que la digoxina podría empeorar esa condición.1 Esta distinción no sólo es importante desde el punto de vista clínico, sino que constituye el contexto de la pregunta que se presenta.Como repaso rápido, los pacientes con insuficiencia cardíaca sistólica suelen tener reducciones del gasto cardíaco (GC). Esta reducción del GC se debe principalmente a una reducción del volumen sistólico (VS). El volumen sistólico está influido por varios factores, como 1) la inotropía (fuerza de contracción ventricular), 2) la precarga (volumen de sangre que regresa al corazón o que llena los ventrículos durante la diástole) y 3) la poscarga (resistencia al flujo sanguíneo durante la sístole). Por lo tanto, cualquier cosa que aumente uno o más de estos factores aumentará la VS y, por lo tanto, en última instancia, aumentará el GC (suponiendo que el pulso no cambie o disminuya).
La mayoría de los médicos reconocen que el papel de la digoxina para ayudar a controlar los síntomas asociados a la insuficiencia cardíaca sistólica tiene que ver con su efecto inotrópico o su capacidad para aumentar la fuerza de contracción.3 Algunos de esos médicos dirán que lo hace aumentando las concentraciones de calcio intracelular (Ca2+). Si bien todo esto es cierto, la verdadera pregunta que conecta este proceso de pensamiento es cómo la digoxina causa este aumento en las concentraciones de calcio citosólico y cómo aumenta en última instancia la inotropía. Para comprender el papel de la digoxina en la insuficiencia cardíaca sistólica, el médico debe entender la fisiología normal del ciclo cardíaco que provoca la contracción ventricular (sístole) y la relajación (diástole).
¿Qué ocurre durante la contracción normal del músculo cardíaco?
Después de la despolarización ventricular (sístole), el sodio (Na+) se desplaza al interior del miocito cardíaco (durante la fase 0 del potencial de acción cardíaco; véase la figura siguiente). Poco después, el potasio (K+) comenzará a salir del miocito cardíaco para situarse en el entorno extracelular (es la fase 1 del potencial de acción). Durante este tiempo, se sabe que las concentraciones citosólicas de Ca2+ aumentan rápidamente a través de una serie de mecanismos (lo que representa la fase 2 del potencial de acción).4 Como se muestra en la segunda figura, el Ca2+ entra en el miocito cardíaco a través de los canales de Ca2+ activados por voltaje de tipo L que recubren el túbulo T de la sarcómera (este canal también se ha denominado DHPR = receptor de dihidropiridina y es el receptor que los bloqueadores de los canales de calcio de tipo «dihidropiridina» (es decir, diltiazem y verapamilo). Una vez que el Ca2+ llega al citosol, se une a la calmodulina para activar la proteína quinasa dependiente de Ca2+/calmodulina (también conocida como quinasa de la cadena ligera de la miosina II (MLKII o CaMKII).5 Una vez que la MLKII se ha formado, puede hacer muchas cosas, una de las cuales es aumentar el Ca2+ citosólico. La MLKII hace esto por dos mecanismos: 1) puede fosforilar los receptores de rianodina (RyR) en el retículo sarcoplásmico, lo que hace que el Ca2+ pase del interior del retículo sarcoplásmico al citosol (citoplasma) y al mismo tiempo puede 2) fosforilar el fosfolamban que coloca el Ca2+ en el interior del retículo sarcoplásmico a través de la Ca2+-ATPasa (SERCA2) durante la repolarización en preparación para ser expulsado a través del RyR en la siguiente despolarización cardíaca.6,7 Sin embargo, la estimulación simpática (como se observa en la insuficiencia cardíaca) también puede aumentar la actividad de la fosfolamba durante la repolarización, poniendo así más Ca2+ en el retículo sarcoplásmico que ahora está listo para la siguiente repolarización o potencial de acción. Este es el intento del cuerpo humano de aumentar la inotropía con la estimulación simpática, especialmente durante la insuficiencia cardíaca sistólica del ventrículo izquierdo, donde el gasto cardíaco está comprometido.
Este aumento del Ca2+ citosólico permite que el Ca2+ se una a la troponinaC, que mueve la tropomiosina, permitiendo así que la miosina y la actina interactúen entre sí para provocar una contracción (o acortamiento del sarcómero).8,9 Cuanto mayor sea la concentración de Ca2+ citosólico, mayor será este proceso. Ahora, durante la repolarización (durante la diástole), gran parte del proceso se invierte. El calcio volverá a entrar en el retículo sarcoplásmico o podrá salir del miocito cardíaco a través de la bomba de intercambio Na+/Ca2+, permitiendo así la relajación de los miocitos cardíacos durante la diástole. Además, la bomba de Na+/K+ ATPasa restablece el potencial de membrana expulsando 3 iones de Na+ de la célula y trayendo de vuelta 2 iones de K+ a la célula durante la repolarización (que representa la fase 3 del potencial de acción).
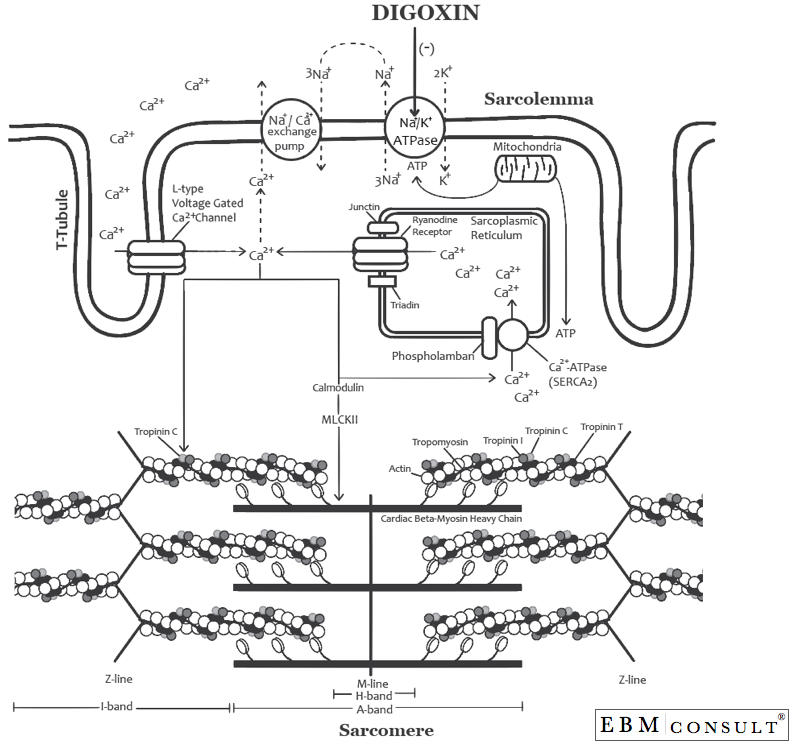
Una vez distribuida en el corazón, la digoxina se une a la forma fosforilada de la subunidad alfa de las bombas Na+/K+ ATPasa e inhibe su actividad (véase la figura siguiente).10,11 Esto hace que la concentración intracelular de Na+ orcitosólico se mantenga más alta, lo que a su vez interrumpe el gradiente de Na+ necesario para el funcionamiento de la bomba de intercambio Na+/ Ca2+, ya que ésta funciona trayendo 3 Na+ desde el exterior del miocito cardíaco hacia el interior del mismo y a cambio tomaría un Ca2+ del interior del miocito y lo trasladaría al exterior de la célula. Por lo tanto, se produce una mayor concentración de Ca2+ citosólico en el interior de la célula con la digoxina, lo que permite un mayor grado de unión a la troponina C y, finalmente, de unión a la miosina/actina, lo que permite una mayor fuerza de contracción (o inotropía).
¿Qué significa esto clínicamente (en lo que respecta a la inotropía)?
Pues, lamentablemente, no tanto como parece o sería deseable. A pesar de tener un mecanismo de acción único y útil para los pacientes con insuficiencia cardíaca, el ensayo Dig no pudo demostrar una reducción de la mortalidad en los pacientes con insuficiencia cardíaca.12 Sin embargo, se sabe que la digoxina reduce los síntomas y las hospitalizaciones asociadas a la insuficiencia cardíaca, razón por la cual se recomienda en el estadio C de la insuficiencia cardíaca sistólica según las directrices de la AHA/ACC.1,12 Por último, es importante tener en cuenta que este pequeño efecto beneficioso sólo se observa con niveles terapéuticos. Dado que la digoxina tiene un índice terapéutico estrecho, es necesario un control adecuado de las concentraciones del fármaco, especialmente en pacientes con una función renal deteriorada o cambiante y al iniciar nuevos medicamentos que son conocidos inhibidores de la bomba de eflujo, la glicoproteína P.
- Jessup M, Abraham WT, Casey WT et al. 2009 focused update: ACCF/AHAGuidelines for the Diagnosis and Management of Heart Failure in Adults: a report of the American College of Cardiology Foundation/American HeartAssociation Task Force on Practice Guidelines: developed incollaboration with the International Society for Heart and LungTransplantation. Circulation 2009;119:1977-2016.
- Cheng JW, Rybak I. Uso de digoxina para la insuficiencia cardíaca y la fibrilación auricular en pacientes de edad avanzada. Am J Geriatr Pharmacother 2010;8:419-27.
- Little WC, Rossi JR, Freeman GL. Comparación de los efectos de la dobutamina y la ouabain en la contracción y relajación del ventrículo izquierdo en perros con el pecho cerrado. J Clin Invest 1987:80;613-620.
- Zhang L, Kelley J, Schmeisser G et al. Formación de complejos entre junctina, triadina, calsequestrina y el receptor de rianodina. Proteinsof the cardiac junctional sarcoplasmic reticulum membrane. J Biol Chem 1997;272:23389-97.
- Couchonnal LF, Anderson ME. The role of calmodulin kinase II in myocardial physiology and disease. Physiology 2008;23:151-9.
- Lanner JT, Georgiou DK, Joshi AD et al. Ryanodine receptors:structure, expression, molecular details, and function in calciumrelease. Cold Spring Harb Perspect Biol 2010;2:a003996.
- Beard NA, Wei L, Dulhunty AF. Control de los canales de liberación de calcio de los rianodinereceptores musculares por proteínas en el lumen del sarcoplasmicretículo. Clin Exp Pharmacol Physiol 2009;36:340-5.
- Kamm KE, Stull JT. Señalización a la cadena ligera reguladora de la miosina en los sarcómeros. J Biol Chem 2011;286:9941-7.
- Ding P, Huang J, Battiprolu PK et al. Cardiac myosin light chain kinase is necessary for myosin regulatory light chain phosphorylationand cardiac performance in vivo. J Biol Chem 2010;285:40819-29.
- Li PW, Ho CS, Swaminathan R et al. The chronic effects oflong-term digoxin administration on Na+/K(+)-ATPase activity in rattissues. Int J Cardiol 1993;40:95-100.
- Eichhorn EJ, Gheorghiade M. Digoxin. Prog Cardiovasc Dis 2002;44:251-66.
- The Digitalis Investigation Group, The effect of digoxin onmortality and morbidity in patients with heart failure, N Engl J Med 1997;336;525-533.
.