El Premio Nobel El logotipo del Premio Nobel
Inglés
Sueco
![]()
La Asamblea Nobel del Instituto Karolinska ha decidido hoy otorgar
el Premio Nobel de Fisiología o Medicina 2016
a
Yoshinori Ohsumi
por sus descubrimientos de los mecanismos de la autofagia
Resumen
El Premio Nobel de este año descubrió y dilucidó los mecanismos que subyacen a la autofagia un proceso fundamental para degradar y reciclar componentes celulares.
La palabra autofagia tiene su origen en las palabras griegas auto-, que significa «yo», y phagein, que significa «comer». Por lo tanto, autofagia denota «comer uno mismo». Este concepto surgió en la década de 1960, cuando los investigadores observaron por primera vez que la célula podía destruir su propio contenido encerrándolo en membranas, formando vesículas en forma de saco que eran transportadas a un compartimento de reciclaje, llamado lisosoma, para su degradación. Las dificultades para estudiar el fenómeno hicieron que se supiera poco hasta que, en una serie de brillantes experimentos a principios de los años 90, Yoshinori Ohsumi utilizó la levadura de panadería para identificar los genes esenciales para la autofagia. A continuación, pasó a dilucidar los mecanismos subyacentes de la autofagia en la levadura y demostró que en nuestras células se utiliza una maquinaria sofisticada similar.
Los descubrimientos de Ohsumi condujeron a un nuevo paradigma en nuestra comprensión de cómo la célula recicla su contenido. Sus descubrimientos abrieron el camino para comprender la importancia fundamental de la autofagia en muchos procesos fisiológicos, como en la adaptación a la inanición o la respuesta a la infección. Las mutaciones en los genes de la autofagia pueden causar enfermedades, y el proceso autofágico está implicado en varias afecciones, como el cáncer y las enfermedades neurológicas.
Degradación: una función central en todas las células vivas
A mediados de la década de 1950, los científicos observaron un nuevo compartimento celular especializado, denominado orgánulo, que contiene enzimas que digieren proteínas, carbohidratos y lípidos. Este compartimento especializado se denomina «lisosoma» y funciona como una estación de trabajo para la degradación de los componentes celulares. El científico belga Christian de Duve recibió el Premio Nobel de Fisiología o Medicina en 1974 por el descubrimiento del lisosoma. Nuevas observaciones realizadas en la década de 1960 mostraron que en ocasiones podían encontrarse grandes cantidades de contenido celular, e incluso orgánulos enteros, en el interior de los lisosomas. Por lo tanto, la célula parecía tener una estrategia para llevar grandes cargas al lisosoma. Otros análisis bioquímicos y microscópicos revelaron un nuevo tipo de vesícula que transportaba la carga celular al lisosoma para su degradación (figura 1). Christian de Duve, el científico que descubrió el lisosoma, acuñó el término autofagia, «autocomida», para describir este proceso. Las nuevas vesículas recibieron el nombre de autofagosomas.
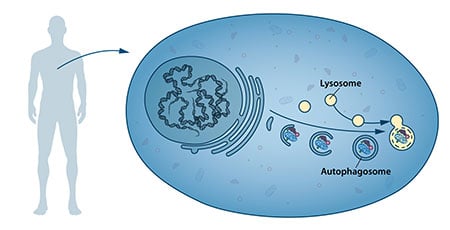
Durante las décadas de 1970 y 1980 los investigadores se centraron en dilucidar otro sistema utilizado para degradar las proteínas, concretamente el «proteasoma». Dentro de este campo de investigación, Aaron Ciechanover, Avram Hershko e Irwin Rose fueron galardonados con el Premio Nobel de Química de 2004 por «el descubrimiento de la degradación de proteínas mediada por la ubiquitina». El proteasoma degrada eficazmente las proteínas una a una, pero este mecanismo no explicaba cómo la célula se deshacía de complejos proteicos más grandes y de orgánulos desgastados. ¿Podría ser el proceso de autofagia la respuesta y, en caso afirmativo, cuáles eran los mecanismos?
Un experimento pionero
Yoshinori Ohsumi había trabajado en varias áreas de investigación, pero al iniciar su propio laboratorio en 1988, centró sus esfuerzos en la degradación de proteínas en la vacuola, un orgánulo que se corresponde con el lisosoma en las células humanas. Las células de levadura son relativamente fáciles de estudiar y, por tanto, se utilizan a menudo como modelo de las células humanas. Son especialmente útiles para la identificación de genes importantes en vías celulares complejas. Pero Ohsumi se enfrentaba a un gran reto: las células de levadura son pequeñas y sus estructuras internas no se distinguen fácilmente al microscopio, por lo que no estaba seguro de que la autofagia existiera en este organismo. Ohsumi pensó que si podía interrumpir el proceso de degradación en la vacuola mientras el proceso de autofagia estaba activo, los autofagosomas deberían acumularse dentro de la vacuola y hacerse visibles al microscopio. Por tanto, cultivó levaduras mutadas que carecían de enzimas de degradación vacuolar y simultáneamente estimuló la autofagia haciendo pasar hambre a las células. Los resultados fueron sorprendentes. En cuestión de horas, las vacuolas se llenaron de pequeñas vesículas que no se habían degradado (Figura 2). Las vesículas eran autofagosomas y el experimento de Ohsumi demostró que la autofagia existe en las células de levadura. Pero lo más importante es que ahora disponía de un método para identificar y caracterizar los genes clave implicados en este proceso. Esto supuso un gran avance y Ohsumi publicó los resultados en 1992.

Se descubren los genes de la autofagia
Ohsumi aprovechó ahora sus cepas de levadura diseñadas en las que los autofagosomas se acumulaban durante la inanición. Esta acumulación no debería producirse si los genes importantes para la autofagia estuvieran inactivados. Ohsumi expuso las células de levadura a una sustancia química que introducía al azar mutaciones en muchos genes, y luego indujo la autofagia. Su estrategia funcionó. Un año después de su descubrimiento de la autofagia en la levadura, Ohsumi había identificado los primeros genes esenciales para la autofagia. En su posterior serie de elegantes estudios, se caracterizaron funcionalmente las proteínas codificadas por estos genes. Los resultados mostraron que la autofagia está controlada por una cascada de proteínas y complejos proteicos, cada uno de los cuales regula una etapa distinta de la iniciación y formación de los autofagosomas (Figura 3).
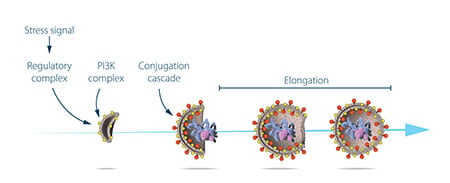
La autofagia – un mecanismo esencial en nuestras células
Tras la identificación de la maquinaria de la autofagia en la levadura, quedaba una pregunta clave. ¿Existía un mecanismo correspondiente para controlar este proceso en otros organismos? Pronto quedó claro que en nuestras células funcionan mecanismos prácticamente idénticos. Ahora se disponía de las herramientas de investigación necesarias para estudiar la importancia de la autofagia en los seres humanos.
Gracias a Ohsumi y a otros que siguieron sus pasos, ahora sabemos que la autofagia controla importantes funciones fisiológicas en las que es necesario degradar y reciclar componentes celulares. La autofagia puede proporcionar rápidamente combustible para la energía y bloques de construcción para la renovación de los componentes celulares, y por lo tanto es esencial para la respuesta celular a la inanición y otros tipos de estrés. Tras una infección, la autofagia puede eliminar las bacterias y los virus intracelulares invasores. La autofagia contribuye al desarrollo embrionario y a la diferenciación celular. Las células también utilizan la autofagia para eliminar las proteínas y los orgánulos dañados, un mecanismo de control de calidad que es fundamental para contrarrestar las consecuencias negativas del envejecimiento.
La autofagia alterada se ha relacionado con la enfermedad de Parkinson, la diabetes tipo 2 y otros trastornos que aparecen en las personas mayores. Las mutaciones en los genes de la autofagia pueden causar enfermedades genéticas. Las alteraciones de la maquinaria autofágica también se han relacionado con el cáncer. En la actualidad se está investigando intensamente para desarrollar fármacos que puedan dirigirse a la autofagia en diversas enfermedades.
La autofagia se conoce desde hace más de 50 años, pero su importancia fundamental en la fisiología y la medicina no se reconoció hasta la investigación de Yoshinori Ohsumi, que cambió el paradigma en la década de 1990. Por sus descubrimientos, ha sido galardonado con el Premio Nobel de Fisiología o Medicina de este año.
Publicaciones clave
Takeshige, K., Baba, M., Tsuboi, S., Noda, T. y Ohsumi, Y. (1992). Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. Journal of Cell Biology 119, 301-311
Tsukada, M. y Ohsumi, Y. (1993). Isolation and characterization of autophagy-defective mutants of Saccharomyces cervisiae. FEBS Letters 333, 169-174
Mizushima, N., Noda, T., Yoshimori, T., Tanaka, Y., Ishii, T., George, M.D., Klionsky, D.J., Ohsumi, M. y Ohsumi, Y. (1998). Un sistema de conjugación de proteínas esencial para la autofagia. Nature 395, 395-398
Ichimura, Y., Kirisako T., Takao, T., Satomi, Y., Shimonishi, Y., Ishihara, N., Mizushima, N., Tanida, I., Kominami, E., Ohsumi, M., Noda, T. y Ohsumi, Y. (2000). A ubiquitin-like system mediates protein lipidation. Nature, 408, 488-492
Yoshinori Ohsumi nació en 1945 en Fukuoka, Japón. Se doctoró en la Universidad de Tokio en 1974. Tras pasar tres años en la Universidad Rockefeller de Nueva York (EE UU), regresó a la Universidad de Tokio, donde estableció su grupo de investigación en 1988. Desde 2009 es profesor del Instituto Tecnológico de Tokio.
La Asamblea Nobel, formada por 50 profesores del Karolinska Institutet, otorga el Premio Nobel de Fisiología o Medicina. Su Comité Nobel evalúa las candidaturas. Desde 1901, el Premio Nobel se concede a los científicos que han realizado los descubrimientos más importantes en beneficio de la humanidad.
El Premio Nobel® es la marca registrada de la Fundación Nobel