Introducción al enlace químico
Diagramas de Lewis para compuestos moleculares/iones
Para dibujar los diagramas de Lewis para compuestos moleculares o iones, sigue los siguientes pasos (utilizaremos el H2O como ejemplo a seguir):
1) Cuenta el número de electrones de valencia del compuesto molecular o ion. Recuerda que si hay dos o más del mismo elemento, entonces tienes que duplicar o multiplicar por el número de átomos que haya el número de electrones de valencia. Sigue el número de grupo de números romanos para ver el número correspondiente de electrones de valencia que hay para ese elemento.
Electrones de valencia:
Oxígeno (O)-Grupo VIA: por tanto, hay 6 electrones de valencia
Hidrógeno (H)-Grupo IA: por tanto, hay 1 electrón de valencia
NOTA: Hay DOS átomos de hidrógeno, por lo que hay que multiplicar 1 electrón de valencia X 2 átomos
Total: 6 + 2 = 8 electrones de valencia
2) Si la molécula en cuestión es un ion, recuerde sumar o restar el número respectivo de electrones al total del paso 1.
Para los iones, si el ion tiene una carga negativa (anión), añada el número correspondiente de electrones al número total de electrones (es decir, si NO3- tiene una carga negativa de 1-, entonces se añade 1 electrón extra al total; 5 + 3(6)= 23 +1 = 24 electrones totales). El signo – significa que la molécula tiene una carga negativa total, por lo que debe tener este electrón extra. Esto se debe a que los aniones tienen una mayor afinidad electrónica (tendencia a ganar electrones). La mayoría de los aniones están compuestos por no metales, que tienen una alta electronegatividad.
Si el ion tiene una carga positiva (catión), reste el número correspondiente de electrones al número total de electrones (es decir, H3O+ tiene una carga positiva de 1+, por lo que se resta 1 electrón extra al total; 6 + 1(3) = 9 – 1 = 8 electrones totales). El signo + significa que la molécula tiene una carga positiva total, por lo que debe faltarle un electrón. Los cationes son positivos y tienen una afinidad de electrones más débil. Están compuestos principalmente por metales; sus radios atómicos son mayores que los de los no metales. En consecuencia, esto significa que el apantallamiento es mayor, y los electrones tienen menos tendencia a ser atraídos por el núcleo «apantallado».
Desde nuestro ejemplo, el agua es una molécula neutra, por lo que no hay que sumar o restar electrones del total.
3) Escriba los símbolos de los elementos, asegurándose de que todos los átomos están contabilizados (es decir, H2O, escriba O y 2 H a cada lado del oxígeno). Empieza añadiendo enlaces simples (1 par de electrones) a todos los átomos posibles mientras te aseguras de que siguen la regla del octeto (con las excepciones de la regla del dúo y otros elementos mencionados anteriormente).
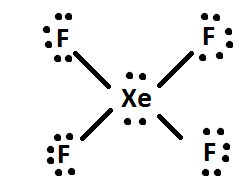
4) Si hay electrones sobrantes, entonces añádelos al átomo central de la molécula (es decir, XeF4 tiene 4 electrones extra después de ser distribuidos, así que los 4 electrones extra se dan a Xe: así. Finalmente, reorganiza los pares de electrones en dobles o triples enlaces si es posible.