JOP. Journal of the Pancreas
Palabras clave
Cetoacidosis diabética; hiperlipidemias; hipertrigliceridemia
INTRODUCCIÓN
La cetoacidosis diabética es una complicación aguda de la diabetes mellitus que pone en peligro la vida. Hasta el 30% de los pacientes, con diabetes recién diagnosticada, presentan cetoacidosis diabética al inicio . La cetoacidosis diabética se define por la tríada de hiperglucemia (glucemia superior a 13,9 mmol/L/ (es decir, 250 mg/dL), cetonemia/cetonuria y acidemia (pH igual o inferior a 7,3 y bicarbonato sérico igual o inferior a 15 mmol/L) . Un aumento leve de las concentraciones de lípidos en suero es una característica común de la diabetes no controlada y no tratada, pero la hiperlipidemia significativa está infravalorada en los niños. A menudo se pasa por alto en la cetoacidosis diabética. Informamos de una niña de 2 años con diabetes mellitus tipo 1 de nueva aparición, que presentó cetoacidosis diabética grave e hiperlipidemia grave.
INFORMe de un caso
Una niña afroamericana de 2 años, previamente sana, presentó vómitos y dolor abdominal durante 2 días. No tenía fiebre, tos ni diarrea. Sus padres también describieron micción frecuente y aumento de la sed asociados a la pérdida de peso, a pesar de tener buen apetito, durante los últimos tres meses. La historia clínica anterior no era destacable y los antecedentes familiares eran negativos para la diabetes.
Al llegar al servicio de urgencias, estaba vomitando, gravemente deshidratada y tenía una respiración rápida pero superficial (hiperventilación con respiración de Kussmaul) con olor a acetona. En la exploración física se observó una frecuencia cardiaca de 146 latidos/min, una presión arterial de 100/66 mmHg, una frecuencia respiratoria de 26 respiraciones/min y una temperatura de 37,7 °C (99,8 °F). Sus parámetros de crecimiento (Figura 1) eran los siguientes: peso 11,8 kg (percentil 10-25) y longitud 86 cm (percentil 5). Sus membranas mucosas estaban secas y el relleno capilar era superior a 5 segundos. El cabello era pálido y escaso. El tórax era claro a la auscultación con ruidos respiratorios bilaterales. El abdomen estaba blando pero sensible. No había hepatoesplenomegalia ni masas palpables. El resto de la exploración no presentaba ninguna anomalía.

Figura 1. Gráfico de crecimiento que muestra un fracaso en el aumento de peso y una mejora tras el tratamiento.
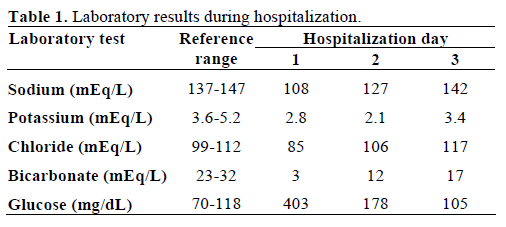
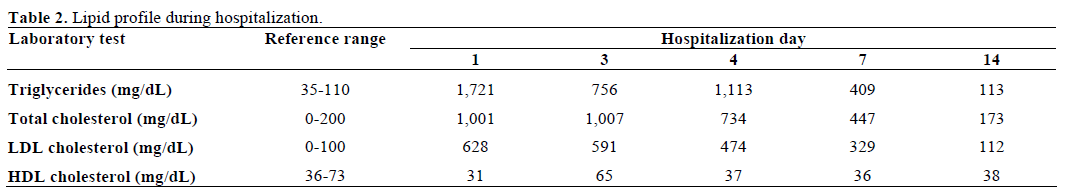
La sangre extraída para el estudio mostró un aspecto lechoso (lipémico) (Figura 2). La química sérica mostró valores anormales de glucosa en sangre (22,4 mmol/L, rango de referencia 3,8-6,5 mmol/L; 403 mg/dL, rango de referencia 70-118 mg/dL), sodio (108 mEq/L, rango de referencia 137-147 mEq/L), potasio (2,8 mEq/L, rango de referencia 3.6-5,2 mEq/L), cloruro (85 mEq/L, rango de referencia 99-112 mEq/L), bicarbonato (3 mEq/L, rango de referencia 23-32 mEq/L) y creatinina sérica (760,2 μmol/L, rango de referencia 53,0-114,9 μmol/L; 8,6 mg/dL, rango de referencia 0,6-1,3 mg/dL). Por otro lado, el nitrógeno ureico en sangre era normal (4,3 mmol/L, rango de referencia 2,4-6,4 mmol/L; 12 mg/dL, rango de referencia 7-18 mg/dL). La gasometría inicial mostró un pH de 6,89 (rango de referencia 7,32-7,42) y un déficit de bases de 29 mmol/L (rango de referencia -3,3-1,2 mmol/L). Las acetonas séricas eran moderadas y la osmolalidad sérica medida era de 287 mosm/kg (rango de referencia 277-302 mosm/kg). El nivel de triglicéridos en suero era de 19,4 mmol/L (rango de referencia 0,39-1,24 mmol/L; 1.721 mg/dL, rango de referencia 35-110 mg/dL) y el colesterol total era de 25,8 mmol/L (rango de referencia 0-5,1 mmol/L; 1.001 mg/dL, rango de referencia 0-200 mg/dL). Su análisis de orina mostró una gravedad específica de 1,027 (rango de referencia 1,005-1,035), +3 cetonas y glucosa. La amilasa y la lipasa séricas eran normales. La hemoglobina glicosilada inicial era del 24,9% (rango de referencia 0-5,7%). Los anticuerpos contra la descarboxilasa del ácido glutámico (GAD65) eran positivos, pero los autoanticuerpos contra los islotes y la insulina eran negativos. Las pruebas de función tiroidea eran normales.

Figura 2. Aspecto lipémico de la muestra de sangre.
Se evaluó la presencia de xantomas y lipemia retiniana, ambos ausentes. Fue ingresada en la unidad de cuidados intensivos y tratada con líquidos intravenosos (reanimación de volumen) e infusión de insulina según el protocolo estándar de cetoacidosis diabética. La hiperlipidemia mejoró con la resolución de la cetoacidosis diabética y los electrolitos séricos volvieron a la normalidad. Los valores de laboratorio, durante el curso hospitalario, se encuentran en las Tablas 1 y 2. Fue dada de alta 9 días después de la hospitalización. Ha sido seguida en nuestra clínica endocrina y su perfil lipídico se mantuvo normal.
DISCUSIÓN
La cetoacidosis diabética suele ocurrir en pacientes diabéticos no cumplidores. También puede ocurrir en pacientes con diabetes de nueva aparición que tienen una deficiencia absoluta de insulina. La insulina no sólo afecta al metabolismo de la glucosa, sino también al de las proteínas y los lípidos. El trastorno del metabolismo de los lípidos en la diabetes mellitus se conoce desde hace muchos años. La insulina inhibe la lipólisis, disminuyendo el suministro de ácidos grasos libres al hígado para la cetogénesis. También aumenta la eliminación de los quilomicrones ricos en triglicéridos de la circulación a través de la estimulación de la lipoproteína lipasa, una enzima extracelular presente en la pared capilar de la mayoría de los tejidos, sobre todo del tejido adiposo y del músculo cardíaco y esquelético. La lipoproteína lipasa descompone los triglicéridos en monoglicéridos, ácidos grasos y glicerol. Los ácidos grasos generados son captados por el músculo y el tejido adiposo, en los que se oxidan o almacenan. Los restos de quilomicrones son absorbidos por el hígado, donde los lisosomas degradan la apolipoproteína y el éster de colesterol en colesterol, ácido graso y aminoácido. El hígado, a su vez, produce lipoproteínas de muy baja densidad (VLDL) compuestas de triglicéridos y las transporta desde el hígado a los tejidos periféricos, donde los triglicéridos son degradados por la lipoproteína lipasa. Este efecto tisular específico de la insulina sobre la lipoproteína lipasa tiene como resultado el desvío de los triglicéridos hacia el tejido adiposo para su almacenamiento.
En condiciones de hipoinsulinemia, como la diabetes mellitus no controlada, la movilización de las grasas está muy aumentada y su eliminación disminuida, lo que da lugar a un exceso de suministro de ácidos grasos libres al hígado. Este aumento de la lipólisis y la disminución de su utilización y excreción da lugar a una hiperlipidemia en los pacientes con deficiencia de insulina. Los pacientes recién diagnosticados con diabetes mellitus tipo 1 que presentan cetoacidosis diabética tienen una deficiencia absoluta de insulina que puede dar lugar a una hiperlipidemia grave como la observada en nuestra paciente. El reconocimiento de esta asociación es importante, ya que la hipertrigliceridemia grave puede complicar la cetoacidosis diabética mediante el desarrollo de pancreatitis, que puede aumentar la morbilidad y la mortalidad. Dado que la tasa de mortalidad es mayor en los niños menores de 5 años que presentan cetoacidosis diabética, puede ser prudente examinarlos para detectar la hiperlipidemia y, si está presente, la pancreatitis.
El nivel de triglicéridos extremadamente anormal puede sugerir la presencia de una deficiencia de LPL (hiperlipidemia de tipo 1) o una deficiencia de apolipoproteína C II, especialmente si las anomalías lipídicas persisten tras la resolución de la cetoacidosis diabética y el control de la diabetes, y pueden ser necesarios estudios genéticos para confirmar o excluir el diagnóstico.
De forma similar, en nuestra paciente la creatinina sérica estaba significativamente elevada en el momento de la presentación, pero volvió a la normalidad tras la corrección de la deshidratación y la acidosis. Suponemos que la deshidratación severa podría haber sido la causa de la descompensación renal aguda.
CONCLUSIÓN
La hiperlipidemia severa que causa suero lipémico en pacientes con cetoacidosis diabética raramente se reporta en niños menores de 3 años. El riesgo de mortalidad en la cetoacidosis diabética grave es mucho mayor en niños muy pequeños. La cetoacidosis diabética asociada a la hipertrigliceridemia, como se observó en nuestro paciente, puede aumentar aún más este riesgo. La identificación precoz de la diabetes mellitus de tipo 1 mediante el reconocimiento de los síntomas y signos, como la poliuria, la polidipsia, la falta de aumento de peso a pesar del aumento del apetito, puede prevenir la morbilidad y la mortalidad graves. Sugerimos que el nivel de lípidos debe ser monitoreado en los niños, independientemente de la edad, cuando se presenta con diabetes mal controlada o cetoacidosis diabética.
Conflicto de intereses
Los autores no tienen ningún conflicto de intereses potencial
- Rewers A, Klingensmith G, Davis C, et al. Presencia de diabeticketoacidosis en el diagnóstico de la diabetes mellitus en la juventud: el Estudio de Búsqueda deDiabetes en la Juventud. Pediatrics. May 2008;121(5):e1258-66.
- Smith CP, Firth D, Bennett S, et al. Ketoacidosis occurring innewly diagnosed and established diabetic children. ActaPaediatr.May 1998;87(5):537-541.
- Rewers A, Chase HP, Mackenzie T, et al. Predictors of acutecomplications in children with type 1 diabetes. JAMA. May 152002;287(19):2511-2518.
- Trachtenbarg DE. Cetoacidosis diabética. Am Fam Physician.2005;71:1705-1714.
- Potter JL, Stone RT. Hiperlipidemia masiva en la cetoacidosis diabética. La importancia clínica del reconocimiento del laboratorio. ClinPediatr (Phila). 1975;14:412-413.
- Nyamugunduru G, Roper H. A difficult case. Childhood onsetinsulin dependent diabetes presenting with severe hyperlipidaemia.BMJ. 1997;314(7073):62-65.
- Farese RV Jr; Yost TJ; Eckel RH. Tissue-specific regulation oflipoprotein lipase activity by insulin/glucose in normal-weighthumans. Metabolism 1991;40:214-216.
- Hsu JH, Wu JR, Chao MC, Dai ZK, Chiou SS, Chen BH. Pancreatitis severa hiperlipidémica asociada a la diabetes. ActaPaediatr.2006;95:378-379.
- Koul PB, Sussmane JB. Emergencias hiperglucémicas metabólicas con pancreatitis aguda en un niño con diabetes mellitus insulinodependiente conocida. Eur J Emerg Med. 2005 ;12:309-311.
- Shenoy SD, Cody D, Rickett AB, Swift PG. Acute pancreatitisand its association with diabetes mellitus in children. J PediatrEndocrinolMetab. 2004;17:1667-1670.
- Nair S, Pitchumoni CS. Cetoacidosis diabética, hiperlipidemia y pancreatitis aguda: el triángulo enigmático. Am J Gastroenterol.1997;92:1560-1561.
- Karagianni C, Stabouli S, Roumeliotou K, Traeger-Synodinos J,Kavazarakis E, Gourgiotis D, et al. Severe hypertriglyceridaemia indiabetic ketoacidosis: clinical and genetic study. Diabet Med.2004;21:380-382.