Biologie cellulaire 07 : Microtubules et division cellulaire
Ce sont les notes du cours 7 du cours de biologie cellulaire de Harvard Extension.
Le cours 6 a présenté les microtubules, et ce cours abordera leur rôle dans la division cellulaire. Voici une vidéo d’introduction :
Vue d’ensemble du cycle cellulaire
Le cycle cellulaire – le processus de division et de réplication cellulaire – est régi par une série d’interrupteurs biochimiques appelés le système de contrôle du cycle cellulaire.
Le cycle cellulaire est divisé en phases qui sont divisées en phases – les gens feront référence aux « 4 phases » mais il y en a en fait 5, et les gens utilisent aussi d’autres mots pour regrouper ces phases, et d’autres mots pour les subdiviser. J’ai fait de mon mieux pour résumer la relation entre ces termes dans le tableau suivant. (modifié/étoffé à partir de Wikipédia) :
| Groupement le plus général | les supposées « 4 phases » | sous-phases | Non-divisant | L’écart 0 (G0) |
|---|---|---|
| interphase | L’écart 1 (G1) | G1a R G1b |
| Synthèse (S) | ||
| Gap 2 (G2) | Mitose | Mitose (M) | prophase prométaphase métaphase anaphase télophase cytokinèse |
Le contenu de chaque phase est magnifiquement résumé dans cette remarquable image Wikimedia Commons de Kelvinsong :

Les cellules humaines qui se divisent le plus rapidement peuvent terminer un cycle cellulaire en 24 heures environ (G1 : 9h, S : 10h, G2 : 4h, M : 30 min). La levure peut terminer un cycle en 30 minutes, et les cellules de drosophile qui se divisent le plus rapidement ne prennent que 8 minutes.
Les contrôleurs maîtres de ce processus comprennent les cyclines, qui régulent la kinase dépendante des cyclines ou CDK. Rappelons que les kinases sont des protéines qui phosphorylent d’autres protéines. La phosphorylation par la CDK de ses cibles permet à la mitose de se poursuivre. Pour être précis, le facteur favorisant la maturation ou MPF est un complexe hétérodimérique obligatoire composé de cycline B et de CDK, qui n’effectue son action de phosphorylation que lorsque les deux protéines sont présentes.
Rôle des microtubules
Les microtubules sont essentiels tout au long du cycle cellulaire – ils organisent les composants cellulaires et les séparent en deux. Voici une série de vidéos du cycle cellulaire qui mettent en évidence le rôle des microtubules :
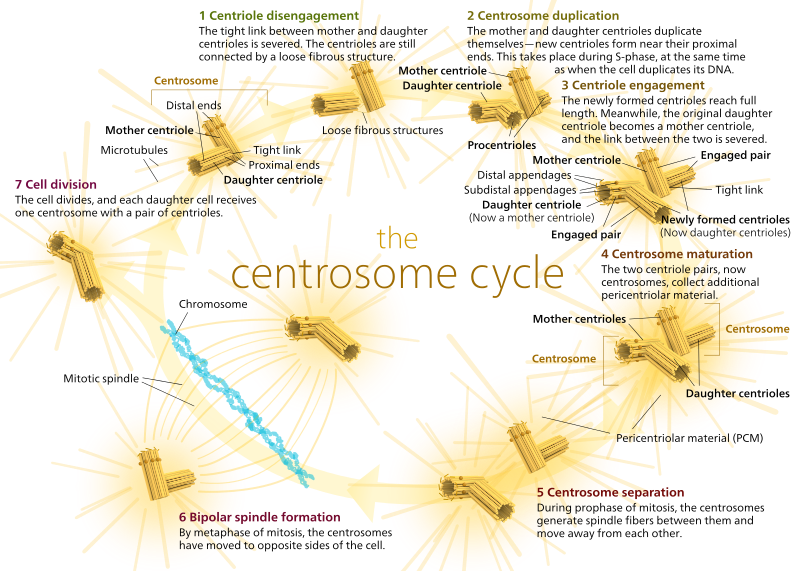
Chez les animaux, les cellules quiescentes et même les cellules en interphase n’ont généralement qu’un seul MTOC, appelé centrosome, qui sert de hub central pour tous les microtubules de la cellule. Un centrosome est composé de deux centrioles comme indiqué ci-dessous (merci encore à Kelvinsong):

Les deux centrioles se désengagent l’un de l’autre et se répliquent pendant la phase S, puis se séparent pour former des » pôles » opposés de la cellule pendant la phase M, de sorte qu’il y a maintenant deux MTOC, dont chacun sera finalement le seul MTOC d’une nouvelle cellule (une autre image patronale de Kelvinsong):
Pendant la mitose, vous avez donc les deux » pôles » de la cellule, chacun avec des microtubules ancrés à l’extrémité (-) et dont les extrémités (+) se chevauchent, pointant vers le centre de la cellule, comme le montre ici (image Wikimedia Commons de Lordjuppiter):
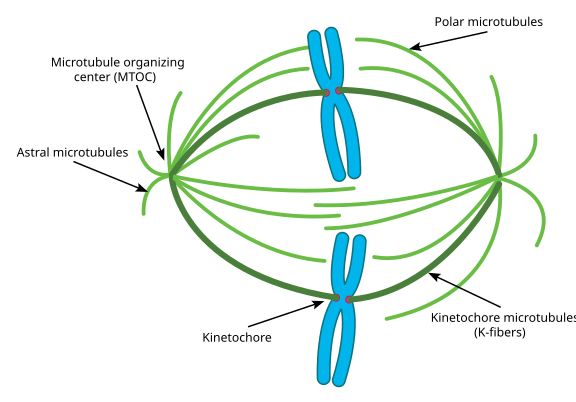
Cet ensemble est appelé appareil fusiforme, et la zone où les microtubules des deux MTOC se chevauchent est appelée » zone d’interdigitation « . Vous entendrez parfois chaque MTOC et son réseau de microtubules en forme d’oursin appelé » astre mitotique « .’
Les microtubules au cours de cette étape seraient de trois catégories :
- Les microtubules astraux pointent vers l’extérieur, vers le cortex cellulaire, afin d’ancrer l’ensemble de l’appareil en fuseau le long de l’axe de la division cellulaire.
- Les microtubules kinétochores s’attachent au kinétochore des chromatides.
- Les microtubules polaires, orientés parallèlement les uns aux autres mais dans des directions opposées, sont cruciaux pour écarter l’appareil fusiforme pendant la mitose. (En fait, les microtubules polaires sont également présents plus tôt et aident à écarter les centrosomes pendant la prophase).
Si vous préférez les photos aux diagrammes, voici à quoi ressemble l’ensemble de l’appareil du fuseau, avec les chromatides en bleu, les microtubules en vert et les cinétochores sous forme de points rouges :

Les microtubules deviennent beaucoup plus dynamiques pendant la mitose : plus de gamma-tubuline favorise une nucléation plus facile, mais XMAP215, un stabilisateur de microtubules, est phosphorylé et donc inactivé pendant la mitose, laissant la Kinésine-13 libre de catastropher les microtubules. Les fortunes se font et se défont rapidement. La demi-vie d’un microtubule pendant la mitose est d’environ 15 minutes, contre 30 minutes pendant l’interphase. On étudie la dynamique des microtubules à l’aide de la méthode FRAP : on ajoute un microtubule fluorescent, on le décolore et on observe la vitesse de réassemblage en fonction de la rapidité avec laquelle la fluorescence réapparaît. Les +Tips jouent également un rôle majeur dans l’aide et l’assemblage des microtubules.
La kinésine-5 est dotée de deux têtes polaires qui se lient à des microtubules opposés et tentent de se diriger vers l’extrémité (+) de chacun. Cela écarte les deux microtubules et fournit la force motrice pour la séparation des MTOC.
L’ADN centromérique a une faible entropie de l’information et des histones spéciales qui diffèrent des autres chromatines. Les centromères sont une partie du génome que vous ne relevez presque jamais dans le séquençage next-gen, même à une profondeur vraiment élevée. Cela s’explique par le fait que les centromères servent un objectif différent de celui de la majeure partie du reste du génome : la séquence qui s’y trouve est favorable à l’interaction avec les protéines centromériques et à la fixation du kinétochore. Les cohésines sont des protéines qui maintiennent les deux chromatides sœurs ensemble. Nous ferons référence aux protéines du kinétochore comme ayant deux couches, le kinétochore interne et le kinétochore externe.
Pendant la prométaphase, les chromosomes se déplacent d’avant en arrière. Les kinésines ancrent les chromosomes aux microtubules du kinétochore au-delà de l’extrémité où la kinésine-13 dépolymérise les microtubules, aidée par une pénurie de dimères de tubuline disponibles. Une combinaison de protéines motrices, de protéines d’interaction avec les microtubules et de pédalage sert à déplacer les chromosomes. Pendant ce temps, la dynéine et la dynactine – des protéines motrices qui marchent vers l’extrémité (-) – travaillent sur les microtubules astraux, tirant les MTOC vers la périphérie de la cellule. En métaphase, les chromatides viennent s’aligner le long de la » plaque de métaphase « .
Pendant ce processus, l’enveloppe nucléaire se dissout et l’importation nucléaire devient donc non pertinente. Ran-GEF se localise près des chromosomes et génère de fortes concentrations de Ran-GTP qui fournit de l’énergie pour certains processus nécessaires ( ?).
Les cellules ont un certain mécanisme pour détecter la tension dans les microtubules qui indique leurs chromatides d’attachement avant que la mitose puisse se poursuivre. S’assurer que chaque chromatide est correctement ancrée est crucial pour éviter l’aneuploïdie.
A propos, d’autres éléments du cytosquelette que les microtubules jouent également un rôle clé dans le cycle cellulaire. Dans la cytokinèse, l’actine forme un anneau contractile et, avec l’aide des protéines motrices myosine II, cintre la cellule en deux.
Importance des organismes modèles
La découverte des processus de régulation du cycle cellulaire s’est fortement appuyée sur certaines caractéristiques soignées d’organismes modèles populaires.
Saccharomyces cerevisiae (levure bourgeonnante) et Schizosaccharomyces pombe (levure à fission) peuvent exister en tant qu’haploïdes ou diploïdes. C’est important car dans la phase haploïde, une seule mutation peut éliminer un gène – il n’est pas nécessaire de toucher les deux allèles. Chez la levure, de nombreuses mutations, notamment dans les gènes Cdc__ (contrôle de la division cellulaire), dépendent de la température : une protéine présentant une mutation faux-sens peut encore fonctionner correctement à des températures « permissives », mais perd sa fonction native à des températures « non permissives ». Cela permet d’étudier le phénotype de knockout (à la température non permissive) tout en ayant la commodité de pouvoir propager facilement les organismes (à la température permissive). L’ensemble du génome de S. cerevisiae est disponible sous forme de bibliothèques de plasmides, ce qui permet de rechercher le plasmide qui résout le phénotype d’un mutant donné. C’est ainsi qu’ont été découverts de nombreux gènes qui régulent le cycle cellulaire.
Dans S. cerivisiae, le bourgeonnement fait partie de la phase G1, et une fois que la cellule fille atteint une certaine taille, à un moment appelé « START », les deux sont engagés à entrer en S et finalement à terminer le cycle cellulaire. Les cellules mammifères ont leur propre point d’engagement appelé point de restriction ou R, en G1, qui est analogue à START.
Les mutants Cdc28 sensibles à la température ne bourgeonnent pas à la température non permissive. Le gène Cdc28 code pour l’homologue de la levure de notre kinase dépendante de la cycline (CDK) qui, quand et seulement quand elle est complexée avec la cycline, peut phosphoryler d’autres protéines pour réguler leur participation aux phases du cycle cellulaire. À la température non permissive, les mutants sensibles à la température restent bloqués, incapables de bourgeonner et d’entrer dans la phase S. Au lieu de cela, ils se comportent comme des cellules sauvages. Au lieu de cela, ils se comportent comme des cellules de type sauvage privées de nutriments : ils grossissent suffisamment pour passer en START mais ne continuent pas.
Le xénope (une sorte de grenouille) s’est révélé critique pour la compréhension du cycle cellulaire, car sa reproduction implique un très grand nombre de cellules (c’est-à-dire suffisamment de matériel de départ pour les Western blots, etc.) parfaitement synchronisées (c’est-à-dire qu’elles sont toutes dans la même phase du cycle cellulaire au même moment. ) qui sont parfaitement synchronisées (c’est-à-dire qu’elles sont toutes dans la même phase du cycle cellulaire au même moment. (Comparez avec la levure, par exemple, où les cellules ne seront pas toutes dans la même phase au même moment). De plus, l’œuf lui-même est grand et facile à manipuler, et plusieurs cycles cellulaires suivent la fécondation. Chez les grenouilles, les œufs commencent la division méiotique mais s’arrêtent ensuite à la phase G2 pendant 8 mois, le temps de grossir et de stocker des éléments qui seront nécessaires à la croissance lors de la fécondation.
Filaments intermédiaires
En plus des microfilaments et des microtubules, les cellules eucaryotes possèdent également une foule » d’autres » protéines du cytosquelette appelées filaments intermédiaires (FI). Bien que plus diversifiés que les microfilaments et les microtubules, les FI ne sont pas un terme fourre-tout pour désigner « tout autre filament », mais plutôt un groupe de protéines apparentées. Ils s’étendent généralement à travers le cytoplasme et l’enveloppe nucléaire interne, sont non polaires et ne sont pas associés à des protéines motrices. Ils ont une grande résistance à la traction et sont très stables, avec un taux d’échange lent et peu de dégradation, bien que la phosphorylation puisse favoriser leur désassemblage. Voici quelques exemples populaires :
- Les kératines sont présentes dans les cellules épithéliales, les cellules mésodermiques et les neurones. Elles assurent la solidité et se présentent sous des formes acides et basiques. Chacune peut former son propre brin, mais la plupart des FI sont constituées de deux brins – un basique et un acide, en quelque sorte tordus l’un autour de l’autre. Les cheveux et les ongles sont constitués de kératine « dure », riche en cystéine pour les liaisons disulfure, qui leur confèrent leur immense résistance. Les permanentes et les défrisages reposent sur la réduction des liaisons disulfure, le remodelage des cheveux, puis la reformation des liaisons disulfure. Vous avez également de la kératine » molle » dans votre peau.
- Les desmines telles que la vimentine se trouvent dans les cellules mésenchymateuses (os, cartilage et graisse).
- Les neurofilaments se trouvent dans les axones neuronaux et en régulent le diamètre, ce qui détermine la vitesse de propagation du potentiel d’action.
- Les lamines sont à la fois les plus répandues et seraient les plus similaires à l’ancêtre phylogénétique de tous les autres FI. Ils fournissent un support structurel à la membrane nucléaire. Ils pourraient aider à espacer les complexes de pores nucléaires et aussi à organiser l’ADN.
Enfin, une vidéo récapitulative :