Expressions moléculaires Biologie cellulaire : Filaments intermédiaires
Filaments intermédiaires
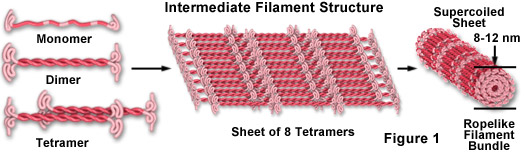
Les filaments intermédiaires constituent une très large classe de protéines fibreuses qui jouent un rôle important en tant qu’éléments à la fois structurels et fonctionnels du cytosquelette. D’une taille comprise entre 8 et 12 nanomètres (de diamètre ; voir Figure 1), les filaments intermédiaires fonctionnent comme des éléments porteurs de tension pour aider à maintenir la forme et la rigidité de la cellule, et servent à ancrer en place plusieurs organites, notamment le noyau et les desmosomes. Les filaments intermédiaires participent également à la formation de la lamina nucléaire, un réseau de mailles en forme de filet qui tapisse la membrane nucléaire interne et régit la forme du noyau.
Bien que tous les eucaryotes contiennent les éléments communs du cytosquelette que sont l’actine et la tubuline (tous deux libres dans le cytoplasme et polymérisés sous forme de microfilaments et de microtubules), les filaments intermédiaires ne sont présents que chez certaines espèces de métazoaires, dont les vertébrés, les nématodes et les mollusques. Chez les vertébrés, la présence et la composition des filaments intermédiaires ne dépendent pas seulement de l’espèce, elles varient également en fonction du type de tissu. Par exemple, la plupart des cellules épithéliales animales contiennent des kératines, une famille diverse de filaments intermédiaires comprenant plus de 50 membres, tandis que les cellules mésenchymateuses et musculaires sont riches en protéines fibreuses, respectivement la vimentine et la desmine. Les filaments intermédiaires présents dans les neurones et les cellules gliales comprennent la périphérine, les neurofilaments et la protéine acide fibrillaire gliale (GFAP). Diverses protéines associées se lient aux filaments intermédiaires, soit pour en améliorer la stabilité (par réticulation), soit pour fournir des sites d’attache à d’autres assemblages de protéines, comme les filaments d’actine et les microtubules.
Une autre classe hautement spécialisée de filaments intermédiaires est constituée par les lamines nucléaires, qui constituent le réseau protéique fibreux qui tapisse l’intérieur de la membrane nucléaire, comme nous l’avons vu plus haut. En raison de leur proximité avec la membrane, les lamines nucléaires aident à fixer les chromosomes à la membrane nucléaire et fournissent des points d’ancrage pour les pores nucléaires. De nombreux scientifiques pensent que les lamines nucléaires sont l’ancêtre évolutif des filaments intermédiaires cytoplasmiques, qui ont évolué par duplication et translocation du produit du gène dans le cytoplasme. La rigidité conférée aux cellules par les réseaux de filaments intermédiaires est particulièrement utile aux animaux à corps mou qui ne possèdent pas d’exosquelette. Les filaments intermédiaires étant très abondants dans les cellules qui sont souvent soumises à des contraintes mécaniques élevées in vivo, il semble que leur rôle principal soit de conférer une résistance physique aux cellules et aux tissus.
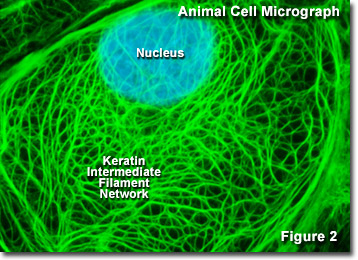
Présentée dans la figure 2 est une image numérique du réseau intermédiaire de kératine trouvé dans une cellule épithéliale de rat kangourou (lignée PtK2), tel que vu à travers un microscope optique à fluorescence. Le vaste réseau entrelacé a été marqué avec des anticorps primaires dirigés contre plusieurs protéines de cytokératine, qui ont ensuite été colorés avec des anticorps secondaires contenant un colorant fluorescent vert. Le noyau a été contre-coloré avec un colorant bleu pour noter son emplacement par rapport au réseau de filaments intermédiaires. La microscopie à fluorescence est un outil important que les scientifiques utilisent pour examiner la structure et la fonction des organites cellulaires internes et du cytosquelette.
Comme l’illustre la figure 1, les peptides monomères de filaments intermédiaires sont une classe de protéines fibreuses allongées avec une région centrale alpha-hélicoïdale coiffée d’extrémités globulaires aux deux extrémités amino et acide carboxylique. Deux des unités monomères forment un dimère de bobine enroulée qui s’associe de lui-même dans une disposition antiparallèle pour former un tétramère décalé, qui est la sous-unité soluble analogue pour le monomère d’actine globulaire et l’hétérodimère de tubuline (existant librement dans le cytoplasme). Les unités de tétramère s’assemblent latéralement pour former une feuille de huit protofilaments parallèles qui sont super enroulés en un faisceau serré. Chaque section transversale de filament intermédiaire étroitement enroulé révèle 32 peptides alpha-hélicoïdaux individuels, ce qui rend le filament facile à plier mais assez difficile à rompre, expliquant ainsi l’extrême rigidité de sa structure. Bien que l’on comprenne moins le mécanisme d’assemblage et de désassemblage des filaments intermédiaires, il est clair que certaines classes sont des structures très dynamiques avec un taux de renouvellement important dans de nombreux types de cellules.
Les mutations dans les gènes des filaments intermédiaires conduisent à une foule de maladies plutôt rares. Par exemple, les kératines défectueuses dans les tissus de la peau conduisent à un trouble connu sous le nom d’épidermolyse bulleuse simplex, qui se manifeste par des cloques cutanées produites par une contrainte mécanique même légère. Des maladies vésiculeuses similaires dues à des mutations des kératines dans d’autres tissus affectent l’œsophage, les yeux et la bouche. Plusieurs maladies neurodégénératives, comme la sclérose latérale amyotrophique (SLA ou maladie de Lou Gehrig), sont associées à des dysfonctionnements du réseau de filaments intermédiaires (neurofilaments), et les défauts des filaments intermédiaires de la desmine produisent des troubles musculaires.
Retour à la structure cellulaire animale
Retour à la structure cellulaire végétale
Questions ou commentaires ? Envoyez-nous un courriel.
© 1995-2021 par Michael W. Davidson et The Florida State University. Tous droits réservés. Aucune image, graphique, logiciel, script ou applet ne peut être reproduit ou utilisé de quelque manière que ce soit sans l’autorisation des détenteurs des droits d’auteur. L’utilisation de ce site Web signifie que vous acceptez toutes les conditions légales énoncées par les propriétaires.
Ce site Web est maintenu par notre
Graphics & Web Programming Team
en collaboration avec Optical Microscopy at the
National High Magnetic Field Laboratory.
Dernière modification : Vendredi 13 novembre 2015 à 02:18
Compte d’accès depuis le 14 décembre 2004 : 173927
Microscopes fournis par :
![]()
![]()