Faits sur l’élément azote
L’élément chimique azote est classé comme un gaz et un non-métal. Il a été découvert en 1772 par Daniel Rutherford et indépendamment par Carl Scheele.

Zone de données
| Classification : | L’azote est un gaz et un non-métal |
| Couleur : | incolore |
| Poids atomique : | 14.0067 |
| État : | gaz |
| Point de fusion : | -210.1 oC, 63,05 K | Point d’ébullition : | -195,8 oC, 77.4 K | Electrons : | 7 |
| Protons : | 7 |
| Neutrons dans l’isotope le plus abondant : | 7 |
| Coquilles d’électrons : | 2,5 |
| Configuration des électrons : | 1s2 2s2 2p3 |
| Densité à 20oC : | 0.0012506 g/cm3 |
Afficher plus, notamment : Chaleurs, énergies, oxydation,
réactions, composés, rayons, conductivités
| Volume atomique: | 17.3 cm3/mol | Structure: | hcp : hexagonal close-packed |
| Capacité thermique spécifique | 1.04 J g-1 K-1 | Chaleur de fusion | 0,720 kJ mol-1 de N2 | Chaleur d’atomisation | 473 kJ mol-1 | Chaleur de vaporisation | 5.57 kJ mol-1 de N2 |
| Première énergie d’ionisation | 1402.3 kJ mol-1 | 2ème énergie d’ionisation | 2856 kJ mol-1 | 3ème énergie d’ionisation | 4578 kJ mol-1 |
| Affinité électronique | -6.75 kJ mol-1 | Nombre d’oxydation minimum | -3 | Nombre d’oxydation minimum commun. | -3 |
| Nombre maximal d’oxydation | 5 | Nombre maximal d’oxydation commune. | 5 |
| Electronégativité (échelle de Pauling) | 3,04 | |
| Volume de polarisabilité | 1.1 Å3 | |
| Réaction à l’air | aucune | |
| Réaction à HNO3 15 M | aucune | |
| Réaction à HCl 6 M | . Réaction avec 6 M HCl | aucune |
| Réaction avec 6 M NaOH | aucune | |
| Oxyde(s) | N2O, NO, NO2, N2O5 | |
| Hydrure(s) | NH3 (ammoniac), N2H4 (hydrazine), HN3 (acide hydrazoïque) | |
| Chlorure(s) | NCl3 | |
| Rayon atomique | 65 pm | |
| Rayon ionique (ion 1+) | – | |
| Rayon ionique (2+ ion) | – | Rayon ionique (3+ ion) | 30 pm | Rayon ionique (1- ion) | – |
| Rayon ionique (2- ion) | – | |
| Rayon ionique (3- ion) | – | |
| Conductivité thermique | 0.02583 W m-1 K-1 | |
| Conductivité électrique | – | Point de congélation/fusion : | -210,1 oC, 63.05 K |
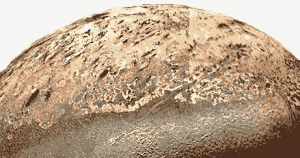
Image de la NASA. Les geysers d’azote de Triton poussent des particules noires à des kilomètres au-dessus de la surface. Celles-ci sont soufflées par les vents sur Triton et forment des dépôts noirs à la surface du satellite. (Voir les faits, ci-dessous.)

L’azote liquide condense la vapeur d’eau de l’air environnant. NASA.
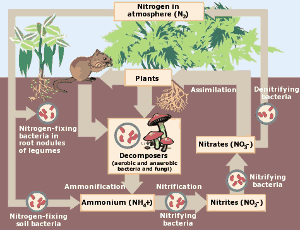
Le cycle de l’azote. Cliquez ici pour agrandir l’image. (Avec l’aimable autorisation de l’Agence de protection de l’environnement)
Découverte de l’azote
En 1674, le médecin anglais John Mayow a démontré que l’air n’est pas un élément unique, il est composé de différentes substances. Il l’a fait en montrant que seule une partie de l’air est combustible. La plus grande partie ne l’est pas. (1)
Presque un siècle plus tard, le chimiste écossais Joseph Black a réalisé des travaux plus détaillés sur l’air. Après avoir retiré l’oxygène et le dioxyde de carbone, il restait une partie de l’air.
Noir a utilisé la combustion du phosphore comme étape finale de l’élimination de l’oxygène. (Le phosphore brûlant a une affinité très élevée pour l’oxygène et est efficace pour l’éliminer complètement). Black a ensuite confié une étude plus approfondie des gaz présents dans l’air à son étudiant en doctorat, Daniel Rutherford. (2)
Rutherford s’appuya sur les travaux de Black et, en une série d’étapes, élimina complètement l’oxygène et le dioxyde de carbone de l’air. Il a montré que, comme le dioxyde de carbone, le gaz résiduel ne pouvait pas entretenir la combustion ou les organismes vivants. Cependant, contrairement au dioxyde de carbone, l’azote est insoluble dans l’eau et les solutions alcalines. Rutherford a rapporté sa découverte en 1772 de » l’air nocif « , que nous appelons aujourd’hui l’azote. (3)
Le pharmacien suédois Carl Scheele a découvert l’azote indépendamment, l’appelant l’air usé.
Scheele a absorbé l’oxygène de plusieurs façons, notamment en utilisant un mélange de soufre et de limaille de fer et en brûlant du phosphore. Après avoir retiré l’oxygène, il a rapporté un gaz résiduel qui ne supporterait pas la combustion et qui avait entre deux tiers et trois quarts du volume de l’air d’origine. Scheele a publié ses résultats en 1777, bien que l’on pense que les travaux ont été réalisés en 1772. (4)
Bien que Rutherford et Scheele soient aujourd’hui conjointement crédités de la découverte de l’azote, il semble qu’elle ait été découverte plus tôt par Henry Cavendish, mais qu’elle n’ait pas été publiée.
Avant 1772 (la date précise est inconnue – Priestley y fait référence dans son ouvrage « Experiments and Observations Made in and Before the Year 1772 ») Cavendish a écrit à Joseph Priestley pour décrire de « l’air brûlé ».
L’air brûlé’ avait été préparé en faisant passer de l’air à plusieurs reprises sur du charbon de bois rouge (éliminant l’oxygène), puis en faisant barboter le gaz restant à travers une solution de potasse caustique (hydroxyde de potassium) qui aurait éliminé le dioxyde de carbone.
Cavendish écrit : » On a constaté que la gravité spécifique de cet air différait très peu de celle de l’air ordinaire ; des deux, il semblait plutôt plus léger. Il éteignait la flamme, et rendait l’air commun impropre à faire brûler les corps de la même manière que l’air fixe, mais à un moindre degré, car une bougie qui brûlait environ 80″ dans l’air commun pur, et qui s’éteignait immédiatement dans l’air commun mélangé avec 6/55 d’air fixe, brûlait environ 26″ dans l’air commun mélangé avec la même portion de cet air brûlé. » (5)
En 1790, le chimiste français Jean-Antoine-Claude Chaptal a nommé l’élément « azote » après que des expériences aient montré qu’il était un constituant du nitre, comme on appelait alors le nitrate de potassium.
Faits intéressants sur l’azote
- Environ 2,5 % du poids des organismes vivants provient de l’azote des molécules organiques.
- De nombreuses molécules de la vie contiennent de l’azote. C’est le quatrième élément le plus abondant dans le corps humain.
- Le composé azoté nitroglycérine peut être utilisé pour soulager l’angine de poitrine, une maladie cardiaque potentiellement mortelle.
- Triton, le satellite de Neptune, possède des geysers de cinq miles de haut, alimentés par l’azote.
Comme la Terre, l’atmosphère de Triton est principalement composée d’azote, mais Triton est si froide que l’azote repose à la surface sous la forme d’un solide dur comme de la pierre. L’azote solide permet à la faible lumière arrivant du soleil de le traverser. Les impuretés sombres dans la glace d’azote ou dans les roches plus sombres sous la glace se réchauffent légèrement sous l’effet de la lumière du soleil, faisant fondre et vaporisant l’azote solide, qui finit par se briser sous forme de geysers qui poussent des particules de glace de un à cinq miles au-dessus de la surface gelée de Triton. - L’azote est le septième élément le plus abondant dans l’univers.
- En 1919, le monde a appris pour la première fois que les noyaux atomiques pouvaient être désintégrés. Ernest Rutherford a rapporté qu’il avait bombardé de l’azote gazeux avec des particules alpha (noyaux d’hélium) et constaté que de l’hydrogène était produit. (Des recherches ultérieures menées par Patrick Blackett ont montré que les particules alpha avaient transmuté l’azote-14 en oxygène-17 plus hydrogène.)
- L’azote de l’univers a été fabriqué, et est fabriqué, par le cycle CNO dans des étoiles plus lourdes que notre soleil. (Voir image ci-dessous)
L’azote et le cycle CNO
Lorsque la première génération d’étoiles de l’univers est née, elle ne contenait que les éléments fabriqués lors du big bang : de l’hydrogène, de l’hélium et une infime quantité de lithium.
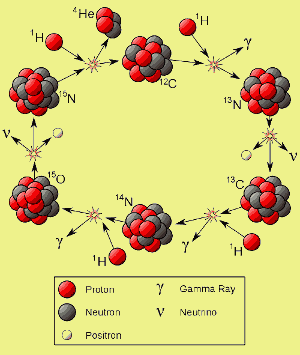
Cliquez ici pour agrandir. Image par Borb.
En brûlant, ces étoiles ont synthétisé des éléments plus lourds, comme le carbone. Les supernovae ont ensuite répandu les éléments plus lourds dans les galaxies où d’autres étoiles sont nées.
Le carbone provenant des supernovae joue un rôle crucial dans la façon dont brûlent de nombreuses étoiles de deuxième génération et plus. Dans les étoiles dont la masse est supérieure à environ 1,1 à 1,5 fois celle de notre soleil, le carbone 12 catalyse la fusion de l’hydrogène en hélium – c’est-à-dire que le carbone 12 prend part à la réaction de fusion, mais n’est pas consommé par celle-ci.
Comme vous pouvez le voir à gauche, le carbone-12 est régénéré à la fin de chaque cycle, le résultat net étant que quatre noyaux d’hydrogène sont consommés et un noyau d’hélium est produit. Cette réaction est appelée le cycle CNO.
Au fil du temps, chaque noyau de carbone-12 peut prendre part à un très grand nombre de cycles. Une partie de l’azote fabriqué au cours du cycle CNO échappe à toute autre réaction. A la fin de la vie d’une étoile, cet azote peut être distribué dans la galaxie. Dans notre système solaire, l’azote d’une étoile morte il y a des milliards d’années a fini par devenir un élément essentiel des protéines et de l’ADN et a formé environ 80 % de l’atmosphère de notre planète.

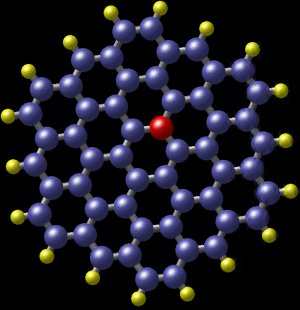
Un hydrocarbure aromatique polycyclique avec de l’azote. Les boules bleues sont des atomes de carbone et les boules jaunes des atomes d’hydrogène. La boule rouge montre la position d’un atome d’azote qui s’intègre presque parfaitement dans la molécule. Cette molécule a été détectée dans la galaxie spirale M81, à quelque 12 millions d’années-lumière de la Terre. (Image : Nasa)
Apparence et caractéristiques
Effets nocifs :
L’azote n’est pas toxique dans des conditions normales.
Le contact direct de la peau avec l’azote liquide provoque de graves gelures.
La décompression chez les plongeurs ou les astronautes peut provoquer le » bends » – un état potentiellement mortel lorsque des bulles d’azote se forment dans le sang.
Caractéristiques:
L’azote est un gaz incolore, inodore, insipide, diatomique et généralement inerte à température et pression standard.
A la pression atmosphérique, l’azote est liquide entre 63 K et 77 K.
Les liquides plus froids que cela sont considérablement plus chers à fabriquer que ne l’est l’azote liquide.
Utilisations de l’azote
L’azote est utilisé pour produire de l’ammoniac (procédé Haber) et des engrais, vitaux pour les méthodes actuelles de production alimentaire. Il est également utilisé pour fabriquer de l’acide nitrique (procédé Ostwald).
Dans la récupération assistée du pétrole, l’azote à haute pression est utilisé pour forcer le pétrole brut qui ne serait pas récupéré autrement hors des puits de pétrole. Les qualités inertes de l’azote trouvent une utilisation dans les industries chimique et pétrolière pour couvrir les réservoirs de stockage d’une couche inerte de gaz.
L’azote liquide est utilisé comme réfrigérant. Les supraconducteurs destinés aux technologies pratiques devraient idéalement ne présenter aucune résistance électrique à des températures supérieures à 63 K, car cette température peut être atteinte de manière relativement bon marché en utilisant l’azote liquide. Les températures inférieures s’accompagnent d’un prix beaucoup plus élevé.
Si l’azote élémentaire n’est pas très réactif, de nombreux composés de l’azote sont instables.
Des oxydes se forment naturellement dans l’acier lors du soudage et ceux-ci affaiblissent la soudure. L’azote peut être utilisé pour exclure l’oxygène pendant le soudage, ce qui permet d’obtenir de meilleures soudures.
Dans la nature, le cycle de l’azote revêt une importance cruciale pour les organismes vivants. L’azote est prélevé dans l’atmosphère et transformé en nitrates par les orages et les bactéries fixatrices d’azote. Les nitrates fertilisent la croissance des plantes où l’azote se fixe dans les acides aminés, l’ADN et les protéines. Il peut ensuite être consommé par les animaux. Finalement, l’azote des plantes et des animaux retourne dans le sol et l’atmosphère et le cycle se répète.
Abondance et isotopes
Abondance croûte terrestre : 19 parties par million en poids, 28 parties par million en moles
Abondance système solaire : 1 000 ppm en poids, 90 ppm en moles
Coût, pur : 0,4 $ par 100g
Coût, en vrac : $ par 100g
Source : Commercialement, l’azote est obtenu à partir de l’air liquide par distillation fractionnée. L’atmosphère terrestre contient de l’ordre de 4 quadrillions de tonnes (4 x 1015) d’azote.
Isotopes : L’azote possède 12 isotopes dont les demi-vies sont connues, avec les numéros de masse 11 à 19. L’azote naturel est un mélange de deux isotopes, 14N et 15N, dont les abondances naturelles sont respectivement de 99,6 % et 0,4 %.

- Alexander Findlay, La chimie au service de l’homme, (2007) p46. Findlay Press.
- Aaron John Ihde, Le développement de la chimie moderne., (2007) p38. Dover Publications.
- Jonathan Shectman, Groundbreaking Scientific Experiments, Inventions, and Discoveries of the 18th Century., (2003) p78. Greenwood Publishing Group.
- Ida Freund, The Experimental Basis Of Chemistry – Suggestions for A Series Of Experiments Illustrative Of The Fundamental Principles Of Chemistry., (2007) p145. Caffin Press.
- George Wilson, The Life of Henry Cavendish., (1851) p28. The Cavendish Society. (pdf – grand téléchargement 31 MB).
- Royston M. Roberts, Serendipity, Accidental Discoveries in Science., (1989) p89. John Wiley and Sons.
Citer cette page
Pour un lien en ligne, veuillez copier et coller l’un des éléments suivants :
<a href="https://www.chemicool.com/elements/nitrogen.html">Nitrogen</a>
ou
<a href="https://www.chemicool.com/elements/nitrogen.html">Nitrogen Element Facts</a>
Pour citer cette page dans un document universitaire, veuillez utiliser la citation suivante conforme à la norme MLA :
"Nitrogen." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/nitrogen.html>.
.