Introduction aux liaisons chimiques
Diagrammes de Lewis pour les composés moléculaires/ions
Pour dessiner les diagrammes de Lewis pour les composés moléculaires ou les ions, suivez les étapes ci-dessous (nous utiliserons H2O comme exemple à suivre):
1) Comptez le nombre d’électrons de valence du composé moléculaire ou de l’ion. Rappelez-vous, s’il y a deux ou plusieurs du même élément, alors vous devez doubler ou multiplier par le nombre d’atomes qu’il y a du nombre d’électrons de valence. Suivez le numéro de groupe en chiffres romains pour voir le nombre correspondant d’électrons de valence qu’il y a pour cet élément.
Electrons de valence :
Oxygène (O)–Groupe VIA : donc, il y a 6 électrons de valence
Hydrogène (H)–Groupe IA : donc, il y a 1 électron de valence
NOTE : Il y a DEUX atomes d’hydrogène, donc multiplier 1 électron de valence X 2 atomes
Total : 6 + 2 = 8 électrons de valence
2) Si la molécule en question est un ion, n’oubliez pas d’ajouter ou de soustraire le nombre respectif d’électrons au total de l’étape 1.
Pour les ions, si l’ion a une charge négative (anion), ajoutez le nombre d’électrons correspondant au nombre total d’électrons (par exemple, si NO3- a une charge négative de 1-, alors vous ajoutez 1 électron supplémentaire au total ; 5 + 3(6)= 23 +1 = 24 électrons totaux). Un signe – signifie que la molécule a une charge négative globale et qu’elle doit donc avoir cet électron supplémentaire. Cela s’explique par le fait que les anions ont une affinité électronique plus élevée (tendance à gagner des électrons). La plupart des anions sont composés de non-métaux, qui ont une électronégativité élevée.
Si l’ion a une charge positive (cation), soustrayez le nombre d’électrons correspondant au nombre total d’électrons (c’est-à-dire que H3O+ a une charge positive de 1+, donc vous soustrayez 1 électron supplémentaire au total ; 6 + 1(3) = 9 – 1 = 8 électrons totaux). Le signe + signifie que la molécule a une charge positive globale, il doit donc lui manquer un électron. Les cations sont positifs et ont une affinité électronique plus faible. Ils sont principalement composés de métaux ; leurs rayons atomiques sont plus grands que ceux des non-métaux. Cela signifie par conséquent que le blindage est accru, et que les électrons ont moins tendance à être attirés par le noyau » blindé « .
D’après notre exemple, l’eau est une molécule neutre, donc aucun électron ne doit être ajouté ou soustrait du total.
3) Écrivez les symboles des éléments, en vous assurant que tous les atomes sont comptabilisés (c’est-à-dire H2O, écrivez O et 2 H de chaque côté de l’oxygène). Commencez par ajouter des liaisons simples (1 paire d’électrons) à tous les atomes possibles tout en vous assurant qu’ils suivent la règle de l’octuor (à l’exception de la règle du duo et des autres éléments mentionnés ci-dessus).
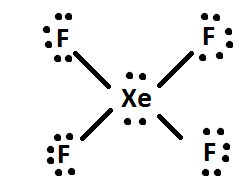
4) S’il reste des électrons, ajoutez-les alors à l’atome central de la molécule (c’est-à-dire que XeF4 a 4 électrons supplémentaires après avoir été distribué, donc les 4 électrons supplémentaires sont donnés à Xe : comme ceci. Enfin, réarrangez les paires d’électrons en liaisons doubles ou triples si possible.