JOP. Journal of the Pancreas
Mots-clés
Acétoacidose diabétique ; Hyperlipidémies ; Hypertriglycéridémie
INTRODUCTION
L’acidocétose diabétique est une complication aiguë du diabète sucré mettant en jeu le pronostic vital. Jusqu’à 30 % des patients, dont le diabète vient d’être diagnostiqué, présentent une acidocétose diabétique dès le début . L’acidocétose diabétique est définie par la triade suivante : hyperglycémie (glycémie supérieure à 13,9 mmol/L/ (c’est-à-dire 250 mg/dL), cétonémie/cétonurie et acidémie (pH égal ou inférieur à 7,3 et bicarbonate sérique égal ou inférieur à 15 mmol/L) . Une légère augmentation des concentrations de lipides sériques est une caractéristique commune du diabète non contrôlé et non traité, mais une hyperlipidémie significative est sous-déclarée chez les enfants. Elle est souvent négligée dans l’acidocétose diabétique. Nous rapportons le cas d’une fillette de 2 ans avec un diabète sucré de type 1 nouvellement apparu, qui a présenté une acidocétose diabétique sévère et une hyperlipidémie sévère.
RAPPORT DE CAS
Une fillette afro-américaine de 2 ans, auparavant en bonne santé, a présenté des vomissements et des douleurs abdominales pendant 2 jours. Elle n’avait ni fièvre, ni toux, ni diarrhée. Ses parents ont également décrit des mictions fréquentes et une soif accrue associées à une perte de poids, malgré un bon appétit, au cours des trois derniers mois. Les antécédents médicaux étaient sans particularité et les antécédents familiaux étaient négatifs pour le diabète.
À son arrivée aux urgences, elle vomissait, était sévèrement déshydratée et avait une respiration rapide mais peu profonde (hyperventilation avec respiration de Kussmaul) avec une odeur d’acétone. Son examen physique a révélé une fréquence cardiaque de 146 battements/min, une pression sanguine de 100/66 mmHg, une fréquence respiratoire de 26 respirations/min et une température de 37,7 °C (99,8 °F). Ses paramètres de croissance (Figure 1) étaient les suivants : poids 11,8 kg (10-25e percentile) et longueur 86 cm (5e percentile). Ses muqueuses étaient sèches et le remplissage capillaire était supérieur à 5 secondes. Ses cheveux étaient pâles et clairsemés. Le thorax était clair à l’auscultation avec des bruits respiratoires bilatéraux. Son abdomen était mou mais sensible. Il n’y avait pas d’hépatosplénomégalie ni de masses palpables. Le reste de son examen était sans particularité.

Figure 1. Carte de croissance montrant un échec de prise de poids et une amélioration après la prise en charge.
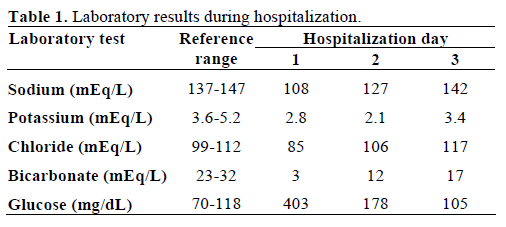
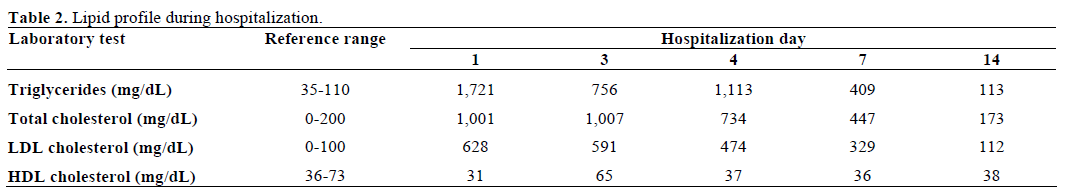
Le sang prélevé pour le bilan a montré un aspect laiteux (lipémique) (figure 2). La chimie sérique a montré des valeurs anormales de glycémie (22,4 mmol/L, plage de référence 3,8-6,5 mmol/L ; 403 mg/dL, plage de référence 70-118 mg/dL), de sodium (108 mEq/L, plage de référence 137-147 mEq/L), de potassium (2,8 mEq/L, plage de référence 3.6-5,2 mEq/L), le chlorure (85 mEq/L, intervalle de référence 99-112 mEq/L), le bicarbonate (3 mEq/L, intervalle de référence 23-32 mEq/L) et la créatinine sérique (760,2 μmol/L, intervalle de référence 53,0-114,9 μmol/L ; 8,6 mg/dL, intervalle de référence 0,6-1,3 mg/dL). En revanche, l’azote uréique sanguin était normal (4,3 mmol/L, intervalle de référence 2,4-6,4 mmol/L ; 12 mg/dL, intervalle de référence 7-18 mg/dL). Les gaz du sang initiaux ont révélé un pH de 6,89 (intervalle de référence : 7,32-7,42) et un déficit de base de 29 mmol/L (intervalle de référence : -3,3-1,2 mmol/L). Les acétones sériques étaient modérées et l’osmolalité sérique mesurée était de 287 mosm/kg (plage de référence 277-302 mosm/kg). Le taux de triglycérides sériques était de 19,4 mmol/L (plage de référence : 0,39-1,24 mmol/L ; 1 721 mg/dL, plage de référence : 35-110 mg/dL) et le cholestérol total était de 25,8 mmol/L (plage de référence : 0-5,1 mmol/L ; 1 001 mg/dL, plage de référence : 0-200 mg/dL). Son analyse d’urine a révélé une gravité spécifique de 1,027 (intervalle de référence 1,005-1,035), +3 cétones et du glucose. L’amylase et la lipase sériques étaient normales. L’hémoglobine glycosylée initiale était de 24,9 % (plage de référence : 0-5,7 %). L’anticorps anti-acide glutamique décarboxylase (GAD65) était positif mais les auto-anticorps anti-cellules des îlots de Langerhans et anti-insuline étaient négatifs. Les tests de la fonction thyroïdienne étaient normaux.

Figure 2. Aspect lipémique de l’échantillon de sang.
Elle a été évaluée pour la présence de xanthomes et de lipémie rétinienne, qui étaient tous deux absents. Elle a été admise à l’unité de soins intensifs et traitée avec des liquides intraveineux (réanimation volumique) et une perfusion d’insuline selon le protocole standard de l’acidocétose diabétique. L’hyperlipidémie s’est améliorée avec la résolution de l’acidocétose diabétique et les électrolytes sériques sont revenus à la normale. Les valeurs de laboratoire, au cours de l’hospitalisation, figurent dans les tableaux 1 et 2. Elle est sortie de l’hôpital 9 jours après son hospitalisation. Elle a été suivie dans notre clinique endocrinienne et son profil lipidique est resté normal.
DISCUSSION
L’acidocétose diabétique survient généralement chez les patients diabétiques non observants. Elle peut également survenir chez les patients atteints d’un nouveau diabète qui présentent une carence absolue en insuline. L’insuline agit non seulement sur le métabolisme du glucose, mais aussi sur celui des protéines et des lipides. Le dérèglement du métabolisme lipidique dans le diabète sucré est connu depuis de nombreuses années. L’insuline inhibe la lipolyse, diminuant ainsi l’apport d’acides gras libres au foie pour la cétogenèse. Elle augmente également l’élimination des chylomicrons riches en triglycérides de la circulation par la stimulation de la lipoprotéine lipase, une enzyme extracellulaire présente dans la paroi capillaire de la plupart des tissus, principalement le tissu adipeux, le muscle cardiaque et le muscle squelettique. La lipoprotéine lipase décompose les triglycérides en monoglycérides, en acides gras et en glycérol. Les acides gras générés sont ensuite absorbés par les muscles et le tissu adipeux, dans lesquels ils sont oxydés ou stockés. Les restes de chylomicrons sont absorbés par le foie où les lysosomes dégradent l’apolipoprotéine et l’ester de cholestérol en cholestérol, acide gras et acide aminé. Le foie produit à son tour des lipoprotéines de très basse densité (VLDL) composées de triglycérides et les transporte du foie vers les tissus périphériques où les triglycérides sont dégradés par la lipoprotéine lipase. Cet effet tissu-spécifique de l’insuline sur la lipoprotéine lipase entraîne le détournement des triglycérides vers le tissu adipeux pour le stockage .
Dans des conditions hypoinsulinémiques, telles que le diabète sucré non contrôlé, la mobilisation des graisses est fortement augmentée et leur clairance diminuée, ce qui entraîne un apport excessif d’acides gras libres au foie. Cette augmentation de la lipolyse et cette diminution de l’utilisation et de l’excrétion entraînent une hyperlipidémie chez les patients présentant une carence en insuline. Les patients nouvellement diagnostiqués avec un diabète sucré de type 1, présentant une acidocétose diabétique, ont une carence absolue en insuline qui peut entraîner une hyperlipidémie sévère comme celle observée chez notre patient. La reconnaissance de cette association est importante car une hypertriglycéridémie sévère peut compliquer l’acidocétose diabétique par le développement d’une pancréatite, ce qui peut augmenter la morbidité et la mortalité. Le taux de mortalité étant plus élevé chez les enfants de moins de 5 ans présentant une acidocétose diabétique, il peut être prudent de les dépister pour une hyperlipidémie et, si elle est présente, pour une pancréatite.
Le niveau de triglycérides extrêmement anormal peut suggérer la présence d’un déficit en LPL (hyperlipidémie de type 1) ou d’un déficit en apolipoprotéine C II, surtout si les anomalies lipidiques persistent après la résolution de l’acidocétose diabétique et le contrôle du diabète, et des études génétiques peuvent être nécessaires pour confirmer ou exclure le diagnostic .
De même, chez notre patient, la créatinine sérique était significativement élevée à la présentation, mais elle est revenue à la normale après la correction de la déshydratation et de l’acidose. Nous supposons que la déshydratation sévère pourrait avoir été la cause de la décompensation rénale aiguë.
CONCLUSION
L’hyperlipidémie sévère provoquant un sérum lipémique chez les patients atteints d’acidocétose diabétique est rarement rapportée chez les enfants de moins de 3 ans. Le risque de mortalité en cas d’acidocétose diabétique sévère est beaucoup plus élevé chez les très jeunes enfants. Une acidocétose diabétique associée à une hypertriglycéridémie, comme celle observée chez notre patient, peut encore augmenter ce risque. L’identification précoce du diabète sucré de type 1 par la reconnaissance des symptômes et des signes, tels que la polyurie, la polydipsie, l’absence de prise de poids malgré une augmentation de l’appétit, peut prévenir une morbidité et une mortalité graves. Nous suggérons que le taux de lipides soit surveillé chez les enfants, quel que soit leur âge, lorsqu’ils sont présentés avec un diabète mal contrôlé ou une acidocétose diabétique.
Conflit d’intérêt
Les auteurs n’ont pas de conflit d’intérêt potentiel
- Rewers A, Klingensmith G, Davis C, et al. Présence de l’acidocétose diabétique au diagnostic du diabète sucré chez les jeunes : l’étude Search forDiabetes in Youth Study. Pediatrics. Mai 2008;121(5):e1258-66.
- Smith CP, Firth D, Bennett S, et al. Ketoacidosis occurring innewly diagnosed and established diabetic children. ActaPaediatr.May 1998;87(5):537-541.
- Rewers A, Chase HP, Mackenzie T, et al. Predictors of acutecomplications in children with type 1 diabetes. JAMA. May 152002;287(19):2511-2518.
- Trachtenbarg DE. L’acidocétose diabétique. Am Fam Physician.2005;71:1705-1714.
- Potter JL, Stone RT. Massive hyperlipidemia in diabeticketoacidosis. L’importance clinique de la reconnaissance en laboratoire. ClinPediatr (Phila). 1975;14:412-413.
- Nyamugunduru G, Roper H. Un cas difficile. Diabète insulinodépendant de l’enfance présentant une hyperlipidémie sévère.BMJ. 1997;314(7073):62-65.
- Farese RV Jr ; Yost TJ ; Eckel RH. Régulation tissu-spécifique de l’activité de la lipoprotéine lipase par l’insuline/glucose chez les personnes de poids normal. Metabolism 1991;40:214-216.
- Hsu JH, Wu JR, Chao MC, Dai ZK, Chiou SS, Chen BH. Pancréatite sévèrehyperlipidémique associée au diabète. ActaPaediatr.2006;95:378-379.
- Koul PB, Sussmane JB. Urgences métaboliques hyperglycémiquesavec pancréatite aiguë chez un enfant avec un diabète insulinodépendant connu. Eur J Emerg Med. 2005 ;12:309-311.
- Shenoy SD, Cody D, Rickett AB, Swift PG. Pancréatite aiguëet son association avec le diabète sucré chez les enfants. J PediatrEndocrinolMetab. 2004;17:1667-1670.
- Nair S, Pitchumoni CS. Acidocétose diabétique, hyperlipidémie et pancréatite aiguë : le triangle énigmatique. Am J Gastroenterol.1997;92:1560-1561.
- Karagianni C, Stabouli S, Roumeliotou K, Traeger-Synodinos J,Kavazarakis E, Gourgiotis D, et al. Severe hypertriglyceridaemia indiabetic ketoacidosis : clinical and genetic study. Diabet Med.2004;21:380-382.