Le potentiel membranaire
Le potentiel membranaire d’une cellule dérive finalement de deux facteurs : la force électrique et la diffusion. La force électrique résulte de l’attraction mutuelle entre des particules ayant des charges électriques opposées (positives et négatives) et de la répulsion mutuelle entre des particules ayant le même type de charge (toutes deux positives ou toutes deux négatives). La diffusion découle de la tendance statistique des particules à se redistribuer des régions où elles sont fortement concentrées vers les régions où la concentration est faible.
VoltageEdit
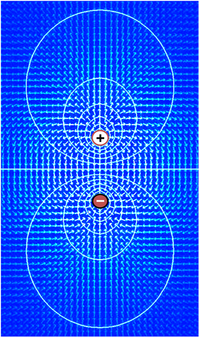
La tension, synonyme de différence de potentiel électrique, est la capacité à faire passer un courant électrique à travers une résistance. En effet, la définition la plus simple d’une tension est donnée par la loi d’Ohm : V=IR, où V est la tension, I le courant et R la résistance. Si une source de tension telle qu’une batterie est placée dans un circuit électrique, plus la tension de la source est élevée, plus la quantité de courant qu’elle fera passer à travers la résistance disponible sera importante. La signification fonctionnelle de la tension réside uniquement dans les différences de potentiel entre deux points d’un circuit. L’idée d’une tension en un seul point n’a aucun sens. Il est conventionnel en électronique d’attribuer une tension de zéro à un élément du circuit choisi arbitrairement, puis d’attribuer des tensions aux autres éléments mesurés par rapport à ce point zéro. Le choix de l’élément comme point zéro n’a aucune importance : la fonction d’un circuit dépend uniquement des différences et non des tensions en tant que telles. Cependant, dans la plupart des cas et par convention, le niveau zéro est le plus souvent attribué à la partie d’un circuit qui est en contact avec la terre.
Le même principe s’applique à la tension en biologie cellulaire. Dans un tissu électriquement actif, la différence de potentiel entre deux points quelconques peut être mesurée en insérant une électrode à chaque point, par exemple une à l’intérieur et une à l’extérieur de la cellule, et en connectant les deux électrodes aux fils de ce qui est par essence un voltmètre spécialisé. Par convention, la valeur de potentiel zéro est attribuée à l’extérieur de la cellule et le signe de la différence de potentiel entre l’extérieur et l’intérieur est déterminé par le potentiel de l’intérieur par rapport au zéro extérieur.
En termes mathématiques, la définition de la tension commence par le concept de champ électrique E, un champ vectoriel attribuant une magnitude et une direction à chaque point de l’espace. Dans de nombreuses situations, le champ électrique est un champ conservatif, ce qui signifie qu’il peut être exprimé comme le gradient d’une fonction scalaire V, c’est-à-dire E = -∇V. Ce champ scalaire V est appelé la distribution de tension. Notez que la définition permet une constante d’intégration arbitraire – c’est pourquoi les valeurs absolues de la tension ne sont pas significatives. En général, les champs électriques ne peuvent être traités comme conservateurs que si les champs magnétiques ne les influencent pas de manière significative, mais cette condition s’applique généralement bien aux tissus biologiques.
Parce que le champ électrique est le gradient de la distribution de tension, des changements rapides de tension dans une petite région impliquent un champ électrique fort ; à l’inverse, si la tension reste approximativement la même sur une grande région, les champs électriques dans cette région doivent être faibles. Un champ électrique fort, équivalent à un fort gradient de tension, implique qu’une force importante est exercée sur toute particule chargée qui se trouve dans la région.
Les ions et les forces qui conduisent leur mouvementModifier
Les signaux électriques au sein des organismes biologiques sont, en général, pilotés par des ions. Les cations les plus importants pour le potentiel d’action sont le sodium (Na+) et le potassium (K+). Ce sont tous deux des cations monovalents qui portent une seule charge positive. Les potentiels d’action peuvent également impliquer le calcium (Ca2+), qui est un cation divalent porteur d’une double charge positive. L’anion chlorure (Cl-) joue un rôle majeur dans les potentiels d’action de certaines algues, mais joue un rôle négligeable dans les potentiels d’action de la plupart des animaux.
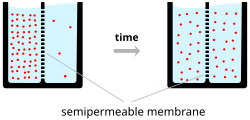
Les ions traversent la membrane cellulaire sous deux influences : la diffusion et les champs électriques. Un exemple simple dans lequel deux solutions-A et B-sont séparées par une barrière poreuse illustre le fait que la diffusion fera en sorte qu’elles se mélangent finalement en solutions égales. Ce mélange se produit en raison de la différence de leurs concentrations. La région à forte concentration va diffuser vers la région à faible concentration. Pour prolonger l’exemple, la solution A contient 30 ions sodium et 30 ions chlorure. De même, la solution B ne contient que 20 ions sodium et 20 ions chlorure. En supposant que la barrière permette aux deux types d’ions de la traverser, un état d’équilibre sera atteint, les deux solutions contenant 25 ions sodium et 25 ions chlorure. Cependant, si la barrière poreuse est sélective quant aux ions qu’elle laisse passer, alors la diffusion seule ne déterminera pas la solution résultante. Revenons à l’exemple précédent et construisons maintenant une barrière perméable uniquement aux ions sodium. Maintenant, seul le sodium est autorisé à diffuser à travers la barrière, de sa concentration plus élevée dans la solution A à la concentration plus faible dans la solution B. Il en résultera une plus grande accumulation d’ions sodium que d’ions chlorure dans la solution B et un nombre moins important d’ions sodium que d’ions chlorure dans la solution A.
Cela signifie qu’il y a une charge positive nette dans la solution B provenant de la concentration plus élevée d’ions sodium chargés positivement que d’ions chlorure chargés négativement. De même, il y a une charge négative nette dans la solution A provenant de la plus grande concentration d’ions chlorure négatifs que d’ions sodium positifs. Puisque les charges opposées s’attirent et que les charges semblables se repoussent, les ions sont maintenant également influencés par les champs électriques ainsi que par les forces de diffusion. Par conséquent, les ions sodium positifs auront moins tendance à se déplacer vers la solution B, désormais plus positive, et à rester dans la solution A, désormais plus négative. Le point auquel les forces des champs électriques contrecarrent complètement la force due à la diffusion est appelé le potentiel d’équilibre. À ce point, le flux net de l’ion spécifique (dans ce cas, le sodium) est nul.
Membranes plasmatiquesEdit

Chaque cellule est enfermée dans une membrane plasmique, qui a la structure d’une bicouche lipidique dans laquelle sont intégrés de nombreux types de grosses molécules. Parce qu’elle est constituée de molécules lipidiques, la membrane plasmique présente intrinsèquement une résistivité électrique élevée, autrement dit une faible perméabilité intrinsèque aux ions. Cependant, certaines des molécules intégrées à la membrane sont capables soit de transporter activement des ions d’un côté à l’autre de la membrane, soit de fournir des canaux par lesquels ils peuvent se déplacer.
Dans la terminologie électrique, la membrane plasmique fonctionne comme une résistance et un condensateur combinés. La résistance provient du fait que la membrane entrave le mouvement des charges à travers elle. La capacité provient du fait que la bicouche lipidique est si mince que l’accumulation de particules chargées d’un côté donne lieu à une force électrique qui attire les particules de charge opposée vers l’autre côté. La capacité de la membrane est relativement peu affectée par les molécules qui y sont incorporées, elle a donc une valeur plus ou moins invariable estimée à environ 2 μF/cm2 (la capacité totale d’un morceau de membrane est proportionnelle à sa surface). En revanche, la conductance d’une bicouche lipidique pure est si faible que, dans les situations biologiques, elle est toujours dominée par la conductance des voies alternatives fournies par les molécules incorporées. Ainsi, la capacité de la membrane est plus ou moins fixe, mais la résistance est très variable.
L’épaisseur d’une membrane plasmique est estimée à environ 7-8 nanomètres. Comme la membrane est si mince, il ne faut pas une tension transmembranaire très importante pour créer un fort champ électrique en son sein. Les potentiels membranaires typiques des cellules animales sont de l’ordre de 100 millivolts (c’est-à-dire un dixième de volt), mais les calculs montrent que cela génère un champ électrique proche du maximum que la membrane peut supporter – il a été calculé qu’une différence de tension beaucoup plus importante que 200 millivolts pourrait provoquer un claquage diélectrique, c’est-à-dire un arc électrique à travers la membrane.
Diffusion et transport facilitésModification
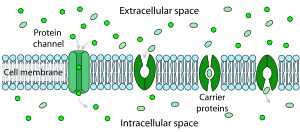
La résistance d’une bicouche lipidique pure au passage des ions à travers elle est très élevée, mais les structures intégrées à la membrane peuvent grandement favoriser le mouvement des ions, de manière active ou passive, par des mécanismes appelés transport facilité et diffusion facilitée. Les deux types de structures qui jouent le plus grand rôle sont les canaux ioniques et les pompes ioniques, tous deux généralement formés d’assemblages de molécules de protéines. Les canaux ioniques constituent des passages par lesquels les ions peuvent se déplacer. Dans la plupart des cas, un canal ionique n’est perméable qu’à certains types d’ions (par exemple, le sodium et le potassium, mais pas le chlorure ou le calcium), et parfois la perméabilité varie en fonction de la direction du mouvement des ions. Les pompes ioniques, également connues sous le nom de transporteurs d’ions ou de protéines porteuses, transportent activement des types spécifiques d’ions d’un côté de la membrane à l’autre, en utilisant parfois l’énergie dérivée des processus métaboliques pour le faire.
Pompes ioniquesModifier
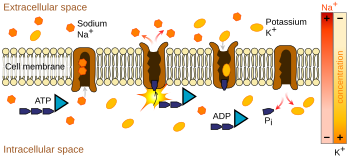
Les pompes ioniques sont des protéines membranaires intégrales qui effectuent un transport actif, c’est-à-dire qui utilisent l’énergie cellulaire (ATP) pour » pomper » les ions contre leur gradient de concentration. De telles pompes ioniques absorbent des ions d’un côté de la membrane (diminuant sa concentration à cet endroit) et les libèrent de l’autre côté (augmentant sa concentration à cet endroit).
La pompe ionique la plus pertinente pour le potentiel d’action est la pompe sodium-potassium, qui transporte trois ions sodium hors de la cellule et deux ions potassium à l’intérieur. En conséquence, la concentration d’ions potassium K+ à l’intérieur du neurone est environ 20 fois plus importante que la concentration extérieure, tandis que la concentration de sodium à l’extérieur est environ neuf fois plus importante qu’à l’intérieur. De manière similaire, d’autres ions ont des concentrations différentes à l’intérieur et à l’extérieur du neurone, comme le calcium, le chlorure et le magnésium.
Si les nombres de chaque type d’ion étaient égaux, la pompe sodium-potassium serait électriquement neutre, mais, en raison de l’échange trois pour deux, elle donne un mouvement net d’une charge positive de l’intracellulaire vers l’extracellulaire pour chaque cycle, contribuant ainsi à une différence de tension positive. La pompe a trois effets : (1) elle rend la concentration de sodium élevée dans l’espace extracellulaire et basse dans l’espace intracellulaire ; (2) elle rend la concentration de potassium élevée dans l’espace intracellulaire et basse dans l’espace extracellulaire ; (3) elle donne à l’espace intracellulaire une tension négative par rapport à l’espace extracellulaire.
La pompe sodium-potassium a un fonctionnement relativement lent. Si une cellule était initialisée avec des concentrations égales de sodium et de potassium partout, il faudrait des heures à la pompe pour établir l’équilibre. La pompe fonctionne constamment, mais devient progressivement moins efficace à mesure que les concentrations de sodium et de potassium disponibles pour le pompage sont réduites.
Les pompes ioniques n’influencent le potentiel d’action qu’en établissant le rapport relatif des concentrations ioniques intracellulaires et extracellulaires. Le potentiel d’action implique principalement l’ouverture et la fermeture des canaux ioniques et non des pompes ioniques. Si les pompes ioniques sont désactivées en supprimant leur source d’énergie ou en ajoutant un inhibiteur tel que la ouabaïne, l’axone peut encore émettre des centaines de milliers de potentiels d’action avant que leurs amplitudes ne commencent à diminuer de manière significative. En particulier, les pompes ioniques ne jouent aucun rôle significatif dans la repolarisation de la membrane après un potentiel d’action.
Une autre pompe ionique fonctionnellement importante est l’échangeur sodium-calcium. Cette pompe fonctionne de manière conceptuellement similaire à la pompe sodium-potassium, sauf qu’à chaque cycle, elle échange trois Na+ de l’espace extracellulaire contre un Ca++ de l’espace intracellulaire. Comme le flux net de charge est dirigé vers l’intérieur, cette pompe fonctionne en effet en « descente » et ne nécessite donc aucune source d’énergie autre que la tension de la membrane. Son effet le plus important est de pomper le calcium vers l’extérieur. Elle permet également un flux de sodium vers l’intérieur, contrecarrant ainsi la pompe sodium-potassium, mais, comme les concentrations globales de sodium et de potassium sont beaucoup plus élevées que les concentrations de calcium, cet effet est relativement peu important. Le résultat net de l’échangeur sodium-calcium est qu’à l’état de repos, les concentrations de calcium intracellulaire deviennent très faibles.
Canaux ioniquesModifier

Les canaux ioniques sont des protéines membranaires intégrales dotées d’un pore à travers lequel les ions peuvent voyager entre l’espace extracellulaire et l’intérieur de la cellule. La plupart des canaux sont spécifiques (sélectifs) pour un ion ; par exemple, la plupart des canaux potassiques sont caractérisés par un rapport de sélectivité de 1000:1 pour le potassium par rapport au sodium, bien que les ions potassium et sodium aient la même charge et ne diffèrent que légèrement dans leur rayon. Le pore du canal est généralement si petit que les ions doivent le traverser en file indienne. Les pores des canaux peuvent être ouverts ou fermés pour le passage des ions, bien qu’un certain nombre de canaux présentent différents niveaux de sous-conductance. Lorsqu’un canal est ouvert, les ions traversent le pore du canal en suivant le gradient de concentration transmembranaire pour cet ion particulier. Le taux de flux ionique à travers le canal, c’est-à-dire l’amplitude du courant monocanal, est déterminé par la conductance maximale du canal et la force motrice électrochimique pour cet ion, qui est la différence entre la valeur instantanée du potentiel de membrane et la valeur du potentiel d’inversion.
Un canal peut avoir plusieurs états différents (correspondant à différentes conformations de la protéine), mais chacun de ces états est soit ouvert, soit fermé. En général, les états fermés correspondent soit à une contraction du pore – le rendant infranchissable par l’ion – soit à une partie distincte de la protéine, bouchant le pore. Par exemple, le canal sodique voltage-dépendant subit une inactivation, au cours de laquelle une partie de la protéine bascule dans le pore, le scellant. Cette inactivation coupe le courant sodique et joue un rôle essentiel dans le potentiel d’action.
Les canaux ioniques peuvent être classés en fonction de la façon dont ils répondent à leur environnement. Par exemple, les canaux ioniques impliqués dans le potentiel d’action sont des canaux sensibles au voltage ; ils s’ouvrent et se ferment en réponse au voltage à travers la membrane. Les canaux à libération de ligands constituent une autre classe importante ; ces canaux ioniques s’ouvrent et se ferment en réponse à la liaison d’une molécule de ligand, comme un neurotransmetteur. D’autres canaux ioniques s’ouvrent et se ferment sous l’effet de forces mécaniques. D’autres canaux ioniques encore – comme ceux des neurones sensoriels – s’ouvrent et se ferment en réponse à d’autres stimuli, comme la lumière, la température ou la pression.
Canaux de fuiteModifier
Les canaux de fuite sont le type de canal ionique le plus simple, dans la mesure où leur perméabilité est plus ou moins constante. Les types de canaux de fuite qui ont la plus grande importance dans les neurones sont les canaux de potassium et de chlorure. Même ces derniers n’ont pas des propriétés parfaitement constantes : Premièrement, la plupart d’entre eux sont voltage-dépendants dans le sens où ils conduisent mieux dans un sens que dans l’autre (en d’autres termes, ce sont des redresseurs) ; deuxièmement, certains d’entre eux sont capables d’être fermés par des ligands chimiques même s’ils n’ont pas besoin de ligands pour fonctionner.
Canaux à ligandsModifier
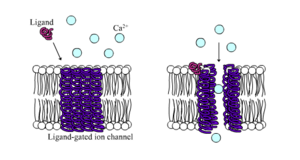
Les canaux ioniques à ligands.gated ion channels sont des canaux dont la perméabilité est fortement augmentée lorsqu’un certain type de ligand chimique se lie à la structure de la protéine. Les cellules animales contiennent des centaines, voire des milliers, de types de ceux-ci. Un grand nombre d’entre eux fonctionnent comme des récepteurs de neurotransmetteurs : ils se trouvent sur des sites postsynaptiques et le ligand chimique qui les verrouille est libéré par le terminal de l’axone présynaptique. Un exemple de ce type est le récepteur AMPA, un récepteur du neurotransmetteur glutamate qui, lorsqu’il est activé, permet le passage des ions sodium et potassium. Un autre exemple est le récepteur GABAA, un récepteur pour le neurotransmetteur GABA qui, lorsqu’il est activé, permet le passage d’ions chlorure.
Les récepteurs des neurotransmetteurs sont activés par des ligands qui apparaissent dans la zone extracellulaire, mais il existe d’autres types de canaux gérés par des ligands qui sont contrôlés par des interactions du côté intracellulaire.
Canaux voltage-dépendantsEdit
Les canaux ioniques voltage-dépendants, également appelés canaux ioniques voltage-dépendants, sont des canaux dont la perméabilité est influencée par le potentiel membranaire. Ils forment un autre groupe très large, chaque membre ayant une sélectivité ionique particulière et une dépendance au voltage particulière. Beaucoup d’entre eux sont également dépendants du temps – en d’autres termes, ils ne répondent pas immédiatement à un changement de tension mais seulement après un délai.
L’un des membres les plus importants de ce groupe est un type de canal sodique dépendant du voltage qui sous-tend les potentiels d’action – ils sont parfois appelés canaux sodiques de Hodgkin-Huxley parce qu’ils ont été initialement caractérisés par Alan Lloyd Hodgkin et Andrew Huxley dans leurs études, couronnées par le prix Nobel, sur la physiologie du potentiel d’action. Le canal est fermé au niveau de la tension de repos, mais s’ouvre brusquement lorsque la tension dépasse un certain seuil, permettant un important afflux d’ions sodium qui produit un changement très rapide du potentiel de la membrane. La récupération d’un potentiel d’action dépend en partie d’un type de canal potassique dépendant de la tension qui est fermé au niveau de tension de repos mais qui s’ouvre suite à la grande variation de tension produite pendant le potentiel d’action.
Potentiel d’inversionEdit
Le potentiel d’inversion (ou potentiel d’équilibre) d’un ion est la valeur de la tension transmembranaire à laquelle les forces diffusives et électriques s’équilibrent, de sorte qu’il n’y a pas de flux net d’ions à travers la membrane. Cela signifie que la tension transmembranaire s’oppose exactement à la force de diffusion de l’ion, de sorte que le courant net de l’ion à travers la membrane est nul et immuable. Le potentiel d’inversion est important car il donne la tension qui agit sur les canaux perméables à cet ion – en d’autres termes, il donne la tension que le gradient de concentration de l’ion génère lorsqu’il agit comme une batterie.
Le potentiel d’équilibre d’un ion particulier est généralement désigné par la notation Eion.Le potentiel d’équilibre de tout ion peut être calculé à l’aide de l’équation de Nernst. Par exemple, le potentiel d’inversion des ions potassium sera le suivant :
E e q , K + = R T z F ln o i , {\displaystyle E_{eq,K^{+}}={\frac {RT}{zF}}\ln {\frac {_{o}}{_{i}}},}

où
- Eeq,K+ est le potentiel d’équilibre du potassium, mesuré en volts
- R est la constante universelle des gaz, égale à 8,314 joules-K-1-mol-1
- T est la température absolue, mesurée en kelvins (= K = degrés Celsius + 273.15)
- z est le nombre de charges élémentaires de l’ion en question impliqué dans la réaction
- F est la constante de Faraday, égale à 96,485 coulombs-mol-1 ou J-V-1-mol-1
- o est la concentration extracellulaire de potassium, mesurée en mol-m-3 ou mmol-l-1
- i est la concentration intracellulaire de potassium
Même si deux ions différents ont la même charge (i.e., K+ et Na+), ils peuvent encore avoir des potentiels d’équilibre très différents, à condition que leurs concentrations extérieures et/ou intérieures diffèrent. Prenons, par exemple, les potentiels d’équilibre du potassium et du sodium dans les neurones. Le potentiel d’équilibre du potassium EK est de -84 mV avec 5 mM de potassium à l’extérieur et 140 mM à l’intérieur. D’autre part, le potentiel d’équilibre du sodium, ENa, est d’environ +66 mV avec environ 12 mM de sodium à l’intérieur et 140 mM à l’extérieur.
Modifications du potentiel membranaire au cours du développementEdit
Le potentiel membranaire de repos d’un neurone change réellement au cours du développement d’un organisme. Pour qu’un neurone puisse finalement adopter sa pleine fonction d’adulte, son potentiel doit être étroitement régulé pendant le développement. Au fur et à mesure qu’un organisme progresse dans son développement, le potentiel de la membrane au repos devient plus négatif. Les cellules gliales se différencient et prolifèrent également à mesure que le développement progresse dans le cerveau. L’ajout de ces cellules gliales augmente la capacité de l’organisme à réguler le potassium extracellulaire. La baisse du potassium extracellulaire peut entraîner une diminution du potentiel membranaire de 35 mV.
Editer l’excitabilité cellulaire
L’excitabilité cellulaire est la variation du potentiel membranaire qui est nécessaire aux réponses cellulaires dans divers tissus. L’excitabilité cellulaire est une propriété qui est induite au cours de l’embriogenèse précoce. L’excitabilité d’une cellule a également été définie comme la facilité avec laquelle une réponse peut être déclenchée. Les potentiels de repos et de seuil constituent la base de l’excitabilité cellulaire et ces processus sont fondamentaux pour la génération de potentiels gradués et d’action.
Les régulateurs les plus importants de l’excitabilité cellulaire sont les concentrations d’électrolytes extracellulaires (c’est-à-dire Na+, K+, Ca2+, Cl-, Mg2+) et les protéines associées. Les protéines importantes qui régulent l’excitabilité cellulaire sont les canaux ioniques dépendant du voltage, les transporteurs d’ions (par exemple, la Na+/K+-ATPase, les transporteurs de magnésium, les transporteurs acide-base), les récepteurs membranaires et les canaux activés par le nucléotide cyclique hyperpolarisé. Par exemple, les canaux potassiques et les récepteurs sensibles au calcium sont des régulateurs importants de l’excitabilité dans les neurones, les myocytes cardiaques et de nombreuses autres cellules excitables comme les astrocytes. L’ion calcium est également le second messager le plus important dans la signalisation des cellules excitables. L’activation des récepteurs synaptiques déclenche des changements durables dans l’excitabilité des neurones. Les hormones thyroïdiennes, surrénales et autres régulent également l’excitabilité cellulaire.
De nombreux types de cellules sont considérés comme ayant une membrane excitable. Les cellules excitables sont les neurones, les myocytes (cardiaques, squelettiques, lisses), les cellules endothéliales vasculaires, les cellules juxtaglomérulaires, les cellules interstitielles de Cajal, de nombreux types de cellules épithéliales (par ex. les cellules bêta, les cellules alpha, les cellules delta, les cellules entéroendocrines), les cellules gliales (par exemple, les astrocytes), les cellules mécanoréceptrices (par exemple, les cellules ciliées et les cellules de Merkel), les cellules chimioréceptrices (par exemple, les cellules glomiques, les récepteurs gustatifs), certaines cellules végétales et éventuellement les cellules immunitaires. Les astrocytes présentent une forme d’excitabilité non électrique basée sur des variations de calcium intracellulaire liées à l’expression de plusieurs récepteurs par lesquels ils peuvent détecter le signal synaptique. Dans les neurones, il existe des propriétés membranaires différentes dans certaines portions de la cellule, par exemple, l’excitabilité dendritique confère aux neurones la capacité de détection de coïncidence d’entrées spatialement séparées.
Circuit équivalentEdit
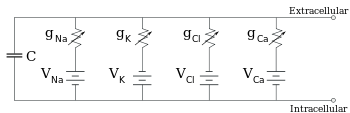
Les électrophysiologistes modélisent les effets des différences de concentration ionique, des canaux ioniques et de la capacité de la membrane en termes de circuit équivalent, qui est destiné à représenter les propriétés électriques d’un petit patch de membrane. Le circuit équivalent se compose d’un condensateur en parallèle avec quatre voies, chacune consistant en une batterie en série avec une conductance variable. La capacité est déterminée par les propriétés de la bicouche lipidique, et est considérée comme fixe. Chacune des quatre voies parallèles provient de l’un des principaux ions, le sodium, le potassium, le chlorure et le calcium. La tension de chaque voie ionique est déterminée par les concentrations de l’ion de chaque côté de la membrane ; voir la section sur le potentiel d’inversion ci-dessus. La conductance de chaque voie ionique à un moment donné est déterminée par les états de tous les canaux ioniques qui sont potentiellement perméables à cet ion, y compris les canaux de fuite, les canaux à ligands et les canaux ioniques à tension.
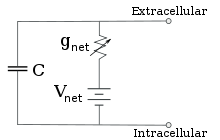
Pour des concentrations d’ions fixes et des valeurs fixes de conductance des canaux ioniques, le circuit équivalent peut être encore réduit, en utilisant l’équation de Goldman comme décrit ci-dessous, à un circuit contenant une capacité en parallèle avec une pile et une conductance. En termes électriques, il s’agit d’un type de circuit RC (circuit résistance-capacité), et ses propriétés électriques sont très simples. À partir de n’importe quel état initial, le courant circulant à travers la conductance ou la capacité décroît de façon exponentielle, avec une constante de temps de τ = RC, où C est la capacité du patch de membrane et R = 1/gnet est la résistance nette. Dans des situations réalistes, la constante de temps se situe généralement dans la plage de 1 à 100 millisecondes. Dans la plupart des cas, les changements de conductance des canaux ioniques se produisent sur une échelle de temps plus rapide, de sorte qu’un circuit RC n’est pas une bonne approximation ; cependant, l’équation différentielle utilisée pour modéliser un patch membranaire est couramment une version modifiée de l’équation de circuit RC.