Le prix Nobel Le logo du prix Nobel
Anglais
Anglais (pdf)
Suédois
![]()
L’Assemblée Nobel du Karolinska Institutet a décidé aujourd’hui de . décerner
le prix Nobel 2016 de physiologie ou médecine
à
Yoshinori Ohsumi
pour ses découvertes des mécanismes de l’autophagie
Résumé
Le lauréat du prix Nobel de cette année a découvert et élucidé les mécanismes qui sous-tendent l’autophagie, un processus fondamental de dégradation et de recyclage des composants cellulaires.
Le mot autophagie trouve son origine dans les mots grecs auto-, qui signifie « soi », et phagein, qui signifie « manger ». Ainsi, l’autophagie désigne le fait de « s’auto-manger ». Ce concept est apparu dans les années 1960, lorsque des chercheurs ont observé pour la première fois que la cellule pouvait détruire son propre contenu en l’enfermant dans des membranes, formant des vésicules semblables à des sacs qui étaient transportées vers un compartiment de recyclage, appelé lysosome, pour y être dégradées. Les difficultés rencontrées pour étudier le phénomène ont fait que l’on en savait peu jusqu’à ce que, dans une série d’expériences brillantes au début des années 1990, Yoshinori Ohsumi utilise la levure de boulanger pour identifier les gènes essentiels à l’autophagie. Il a ensuite élucidé les mécanismes sous-jacents de l’autophagie chez la levure et a montré que des mécanismes sophistiqués similaires sont utilisés dans nos cellules.
Les découvertes d’Ohsumi ont conduit à un nouveau paradigme dans notre compréhension de la façon dont la cellule recycle son contenu. Ses découvertes ont ouvert la voie à la compréhension de l’importance fondamentale de l’autophagie dans de nombreux processus physiologiques, comme l’adaptation à la famine ou la réponse aux infections. Des mutations dans les gènes de l’autophagie peuvent provoquer des maladies, et le processus autophagique est impliqué dans plusieurs affections, notamment le cancer et les maladies neurologiques.
La dégradation – une fonction centrale dans toutes les cellules vivantes
Au milieu des années 1950, les scientifiques ont observé un nouveau compartiment cellulaire spécialisé, appelé organite, contenant des enzymes qui digèrent les protéines, les glucides et les lipides. Ce compartiment spécialisé est appelé « lysosome » et fonctionne comme un poste de travail pour la dégradation des constituants cellulaires. Le scientifique belge Christian de Duve a reçu le prix Nobel de physiologie ou de médecine en 1974 pour la découverte du lysosome. De nouvelles observations au cours des années 1960 ont montré que de grandes quantités de contenu cellulaire, et même des organites entiers, pouvaient parfois se trouver à l’intérieur des lysosomes. La cellule semblait donc disposer d’une stratégie pour acheminer de grosses cargaisons vers le lysosome. Des analyses biochimiques et microscopiques plus poussées ont révélé l’existence d’un nouveau type de vésicule transportant des cargaisons cellulaires vers le lysosome pour y être dégradées (figure 1). Christian de Duve, le scientifique à l’origine de la découverte du lysosome, a inventé le terme autophagie, « auto-mangement », pour décrire ce processus. Les nouvelles vésicules ont été baptisées autophagosomes.
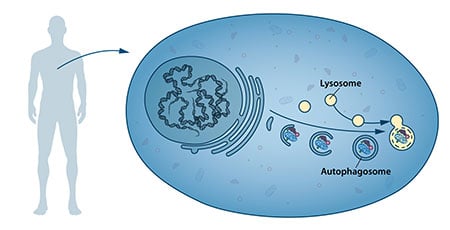
Durant les années 1970 et 1980, les chercheurs se sont attachés à élucider un autre système utilisé pour dégrader les protéines, à savoir le « protéasome ». Dans ce domaine de recherche, Aaron Ciechanover, Avram Hershko et Irwin Rose ont reçu le prix Nobel de chimie 2004 pour « la découverte de la dégradation des protéines médiée par l’ubiquitine ». Le protéasome dégrade efficacement les protéines une par une, mais ce mécanisme n’explique pas comment la cellule se débarrasse des complexes protéiques plus importants et des organites usés. Le processus d’autophagie pourrait-il être la réponse et, si oui, quels en étaient les mécanismes ?
Une expérience révolutionnaire
Yoshinori Ohsumi avait été actif dans divers domaines de recherche, mais en créant son propre laboratoire en 1988, il a concentré ses efforts sur la dégradation des protéines dans la vacuole, un organite qui correspond au lysosome dans les cellules humaines. Les cellules de levure sont relativement faciles à étudier et sont donc souvent utilisées comme modèle pour les cellules humaines. Elles sont particulièrement utiles pour l’identification de gènes importants dans des voies cellulaires complexes. Mais Ohsumi a été confronté à un défi de taille : les cellules de levure sont petites et leurs structures internes ne sont pas faciles à distinguer au microscope ; il n’était donc pas certain que l’autophagie existe dans cet organisme. Ohsumi s’est dit que s’il pouvait interrompre le processus de dégradation dans la vacuole alors que le processus d’autophagie était actif, les autophagosomes devraient s’accumuler dans la vacuole et devenir visibles au microscope. Il a donc cultivé des levures mutantes dépourvues d’enzymes de dégradation vacuolaire et a simultanément stimulé l’autophagie en affamant les cellules. Les résultats ont été frappants ! En quelques heures, les vacuoles étaient remplies de petites vésicules qui n’avaient pas été dégradées (figure 2). Ces vésicules étaient des autophagosomes et l’expérience d’Ohsumi a prouvé que l’autophagie existe dans les cellules de levure. Mais plus important encore, il disposait désormais d’une méthode pour identifier et caractériser les gènes clés impliqués dans ce processus. Il s’agissait d’une avancée majeure et Ohsumi a publié les résultats en 1992.

Des gènes d’autophagie sont découverts
Ohsumi a maintenant tiré parti de ses souches de levure modifiées dans lesquelles les autophagosomes s’accumulent pendant la famine. Cette accumulation ne devrait pas se produire si les gènes importants pour l’autophagie étaient inactivés. Ohsumi a exposé les cellules de levure à un produit chimique qui a introduit de façon aléatoire des mutations dans de nombreux gènes, puis il a induit l’autophagie. Sa stratégie a fonctionné ! Moins d’un an après sa découverte de l’autophagie chez la levure, Ohsumi avait identifié les premiers gènes essentiels à l’autophagie. Dans la série d’études élégantes qui a suivi, les protéines codées par ces gènes ont été caractérisées fonctionnellement. Les résultats ont montré que l’autophagie est contrôlée par une cascade de protéines et de complexes protéiques, chacun régulant une étape distincte de l’initiation et de la formation de l’autophagosome (figure 3).
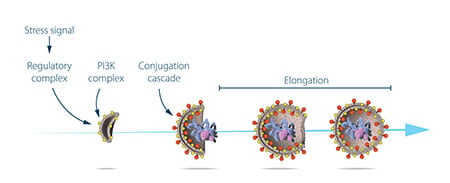
Autophagie – un mécanisme essentiel dans nos cellules
Après l’identification de la machinerie de l’autophagie chez la levure, une question clé restait posée. Existait-il un mécanisme correspondant pour contrôler ce processus dans d’autres organismes ? Il est rapidement apparu que des mécanismes pratiquement identiques fonctionnent dans nos propres cellules. Les outils de recherche nécessaires pour étudier l’importance de l’autophagie chez l’homme étaient désormais disponibles.
Grâce à Ohsumi et à d’autres qui ont suivi ses traces, nous savons maintenant que l’autophagie contrôle des fonctions physiologiques importantes où les composants cellulaires doivent être dégradés et recyclés. L’autophagie peut fournir rapidement du carburant pour l’énergie et des blocs de construction pour le renouvellement des composants cellulaires, et est donc essentielle pour la réponse cellulaire à la famine et à d’autres types de stress. Après une infection, l’autophagie peut éliminer les bactéries et les virus intracellulaires envahissants. L’autophagie contribue au développement de l’embryon et à la différenciation cellulaire. Les cellules utilisent également l’autophagie pour éliminer les protéines et les organites endommagés, un mécanisme de contrôle de la qualité qui est essentiel pour contrecarrer les conséquences négatives du vieillissement.
Une autophagie perturbée a été liée à la maladie de Parkinson, au diabète de type 2 et à d’autres troubles qui apparaissent chez les personnes âgées. Des mutations dans les gènes de l’autophagie peuvent provoquer des maladies génétiques. Les perturbations de la machinerie autophagique ont également été liées au cancer. D’intenses recherches sont actuellement en cours pour développer des médicaments qui peuvent cibler l’autophagie dans diverses maladies.
L’autophagie est connue depuis plus de 50 ans, mais son importance fondamentale en physiologie et en médecine n’a été reconnue qu’après les recherches de Yoshinori Ohsumi, qui ont changé le paradigme dans les années 1990. Pour ses découvertes, il reçoit cette année le prix Nobel de physiologie ou de médecine.
Principales publications
Takeshige, K., Baba, M., Tsuboi, S., Noda, T. et Ohsumi, Y. (1992). Autophagie dans la levure démontrée avec des mutants déficients en protéinase et des conditions pour son induction. Journal of Cell Biology 119, 301-311
Tsukada, M. et Ohsumi, Y. (1993). Isolation et caractérisation des mutants défectueux de l’autophagie de Saccharomyces cervisiae. FEBS Letters 333, 169-174
Mizushima, N., Noda, T., Yoshimori, T., Tanaka, Y., Ishii, T., George, M.D., Klionsky, D.J., Ohsumi, M. et Ohsumi, Y. (1998). Un système de conjugaison des protéines essentiel à l’autophagie. Nature 395, 395-398
Ichimura, Y., Kirisako T., Takao, T., Satomi, Y., Shimonishi, Y., Ishihara, N., Mizushima, N., Tanida, I., Kominami, E., Ohsumi, M., Noda, T. et Ohsumi, Y. (2000). A ubiquitin-like system mediates protein lipidation. Nature, 408, 488-492
Yoshinori Ohsumi est né en 1945 à Fukuoka, au Japon. Il a obtenu un doctorat de l’Université de Tokyo en 1974. Après avoir passé trois ans à l’Université Rockefeller, à New York, aux États-Unis, il est retourné à l’Université de Tokyo où il a établi son groupe de recherche en 1988. Il est depuis 2009 professeur à l’Institut de technologie de Tokyo.
L’Assemblée Nobel, composée de 50 professeurs du Karolinska Institutet, décerne le prix Nobel de physiologie ou de médecine. Son comité Nobel évalue les candidatures. Depuis 1901, le prix Nobel est décerné aux scientifiques qui ont fait les découvertes les plus importantes au profit de l’humanité.
Le prix Nobel® est une marque déposée de la Fondation Nobel
.