Monosaccharide
À quelques exceptions près (par exemple, le désoxyribose), les monosaccharides ont cette formule chimique : (CH2O)x, où par convention x ≥ 3. Les monosaccharides peuvent être classés selon le nombre x d’atomes de carbone qu’ils contiennent : triose (3), tétrose (4), pentose (5), hexose (6), heptose (7), et ainsi de suite.
Le glucose, utilisé comme source d’énergie et pour la synthèse de l’amidon, du glycogène et de la cellulose, est un hexose. Le ribose et le désoxyribose (respectivement dans l’ARN et l’ADN) sont des sucres pentoses. Les cétoses, le manno-heptulose et le sédoheptulose sont des exemples d’heptoses. Les monosaccharides à huit carbones ou plus sont rarement observés car ils sont assez instables. Dans les solutions aqueuses, les monosaccharides existent sous forme de cycles s’ils ont plus de quatre carbones.
Monosaccharides à chaîne linéaireEdit
Les monosaccharides simples ont un squelette carboné linéaire et non ramifié avec un groupe fonctionnel carbonyle (C=O), et un groupe hydroxyle (OH) sur chacun des atomes de carbone restants. Par conséquent, la structure moléculaire d’un monosaccharide simple peut être écrite sous la forme H(CHOH)n(C=O)(CHOH)mH, où n + 1 + m = x ; de sorte que sa formule élémentaire est CxH2xOx.
Par convention, les atomes de carbone sont numérotés de 1 à x le long du squelette, en commençant par l’extrémité la plus proche du groupe C=O. Les monosaccharides sont les unités les plus simples des glucides et la forme la plus simple du sucre.
Si le carbonyle est en position 1 (c’est-à-dire que n ou m est nul), la molécule commence par un groupe formyle H(C=O)- et est techniquement un aldéhyde. Dans ce cas, le composé est appelé un aldose. Sinon, la molécule possède un groupe céto, un carbonyle -(C=O)- entre deux atomes de carbone ; il s’agit alors formellement d’une cétone, et on l’appelle un cétose. Les cétoses d’intérêt biologique ont généralement le carbonyle en position 2.
Les différentes classifications ci-dessus peuvent être combinées, donnant lieu à des noms tels que « aldohexose » et « cétotriose ».
Une nomenclature plus générale des monosaccharides à chaîne ouverte combine un préfixe grec pour indiquer le nombre de carbones (tri-, tétr-, pent-, hex-, etc.) avec les suffixes « -ose » pour les aldoses et « -ulose » pour les cétoses. Dans ce dernier cas, si le carbonyle n’est pas en position 2, sa position est alors indiquée par un infixe numérique. Ainsi, par exemple, H(C=O)(CHOH)4H est pentose, H(CHOH)(C=O)(CHOH)3H est pentulose, et H(CHOH)2(C=O)(CHOH)2H est pent-3-ulose.
Stéro-isomères à chaîne ouverteEdit
Deux monosaccharides ayant des graphes moléculaires équivalents (même longueur de chaîne et même position du carbonyle) peuvent néanmoins être des stéréo-isomères distincts, dont les molécules diffèrent par leur orientation spatiale. Cela ne se produit que si la molécule contient un centre stéréogénique, plus précisément un atome de carbone qui est chiral (relié à quatre sous-structures moléculaires distinctes). Ces quatre liaisons peuvent avoir l’une des deux configurations dans l’espace, qui se distinguent par leur chiralité. Dans un monosaccharide simple à chaîne ouverte, chaque carbone est chiral, à l’exception du premier et du dernier atome de la chaîne, et (dans les cétoses) du carbone portant le groupe céto.
Par exemple, le tricétose H(CHOH)(C=O)(CHOH)H (glycérone, dihydroxyacétone) n’a pas de centre stéréogénique, et existe donc comme un seul stéréoisomère. L’autre triose, l’aldose H(C=O)(CHOH)2H (glycéraldéhyde), possède un carbone chiral – le carbone central, numéro 2 – qui est lié aux groupes -H, -OH, -C(OH)H2 et -(C=O)H. Il existe donc deux stéréoisomères. Par conséquent, il existe sous la forme de deux stéréoisomères dont les molécules sont des images miroir l’une de l’autre (comme un gant gauche et un gant droit). Les monosaccharides à quatre atomes de carbone ou plus peuvent contenir plusieurs atomes de carbone chiraux, de sorte qu’ils ont généralement plus de deux stéréoisomères. Le nombre de stéréoisomères distincts ayant le même diagramme est limité par 2c, où c est le nombre total de carbones chiraux.
La projection de Fischer est une façon systématique de dessiner la formule squelettique d’un monosaccharide acyclique de sorte que la main de chaque carbone chiral soit bien spécifiée. Chaque stéréoisomère d’un monosaccharide simple à chaîne ouverte peut être identifié par les positions (droite ou gauche) dans le diagramme de Fischer des hydroxyles chiraux (les hydroxyles attachés aux carbones chiraux).
La plupart des stéréoisomères sont eux-mêmes chiraux (distincts de leurs images miroir). Dans la projection de Fischer, deux isomères à image miroir diffèrent en ayant les positions de tous les hydroxyles chiraux inversées de droite à gauche. Les isomères en image miroir sont chimiquement identiques dans des environnements non chiraux, mais ont généralement des propriétés biochimiques et des occurrences très différentes dans la nature.
Alors que la plupart des stéréoisomères peuvent être disposés en paires de formes en image miroir, il existe certains stéréoisomères non chiraux qui sont identiques à leurs images miroir, malgré la présence de centres chiraux. Cela se produit lorsque le graphe moléculaire est symétrique, comme dans le cas des 3-cétopentoses H(CHOH)2(CO)(CHOH)2H, et que les deux moitiés sont des images miroir l’une de l’autre. Dans ce cas, l’effet miroir est équivalent à une rotation d’un demi-tour. Pour cette raison, il n’existe que trois stéréoisomères distincts du 3-cétopentose, même si la molécule possède deux carbones chiraux.
Les stéréoisomères distincts qui ne sont pas des images miroir l’un de l’autre ont généralement des propriétés chimiques différentes, même dans des environnements non chiraux. Par conséquent, chaque paire de miroirs et chaque stéréoisomère non chiral peut recevoir un nom de monosaccharide spécifique. Par exemple, il existe 16 stéréoisomères d’aldohexose distincts, mais le nom « glucose » désigne une paire spécifique d’aldohexoses en miroir. Dans la projection de Fischer, l’un des deux isomères du glucose a l’hydroxyle à gauche sur C3, et à droite sur C4 et C5, tandis que l’autre isomère présente le schéma inverse. Ces noms spécifiques de monosaccharides ont des abréviations conventionnelles à trois lettres, comme « Glu » pour le glucose et « Thr » pour le thréose.
Généralement, un monosaccharide avec n carbones asymétriques a 2n stéréoisomères. Le nombre de stéréoisomères à chaîne ouverte pour un monosaccharide d’aldose est supérieur de un à celui d’un monosaccharide de cétose de même longueur. Chaque cétose aura 2(n-3) stéréoisomères où n > 2 est le nombre de carbones. Chaque aldose aura 2(n-2) stéréoisomères où n > 2 est le nombre de carbones.On parle aussi d’épimères qui ont la disposition différente des groupes -OH et -H sur les atomes de carbone asymétriques ou chiraux (cela ne s’applique pas aux carbones ayant le groupe fonctionnel carbonyle).
Configuration des monosaccharidesModification
Comme beaucoup de molécules chirales, les deux stéréoisomères du glycéraldéhyde vont progressivement faire tourner la direction de polarisation de la lumière polarisée linéairement lorsqu’elle le traverse, même en solution. Les deux stéréoisomères sont identifiés par les préfixes D- et L-, selon le sens de rotation : Le D-glycéraldéhyde est dextrogyre (il fait tourner l’axe de polarisation dans le sens des aiguilles d’une montre), tandis que le L-glycéraldéhyde est lévogyre (il le fait tourner dans le sens inverse des aiguilles d’une montre).

Les préfixes D- et L- sont également utilisés avec d’autres monosaccharides, pour distinguer deux stéréoisomères particuliers qui sont des images miroir l’un de l’autre. À cette fin, on considère le carbone chiral le plus éloigné du groupe C=O. Ses quatre liaisons doivent être reliées à -H-. Ses quatre liaisons doivent être reliées à -H, -OH, -C(OH)H et au reste de la molécule. Si la molécule peut être tournée dans l’espace de façon à ce que les directions de ces quatre groupes correspondent à celles des groupes analogues dans le C2 du D-glycéraldéhyde, l’isomère reçoit le préfixe D-. Sinon, il reçoit le préfixe L-.
Dans la projection de Fischer, les préfixes D- et L- spécifient la configuration au niveau de l’atome de carbone qui est le deuxième en partant du bas : D- si l’hydroxyle est à droite, et L- s’il est à gauche.
Notez que les préfixes D- et L- n’indiquent pas le sens de rotation de la lumière polarisée, qui est un effet combiné de la disposition au niveau de tous les centres chiraux. Cependant, les deux énantiomères feront toujours tourner la lumière dans des directions opposées, de la même quantité. Voir aussi le système D/L.
Cyclisation des monosaccharidesModifier
Un monosaccharide passe souvent de la forme acyclique (chaîne ouverte) à une forme cyclique, par une réaction d’addition nucléophile entre le groupe carbonyle et l’un des hydroxyles de la même molécule. La réaction crée un cycle d’atomes de carbone fermé par un atome d’oxygène de pontage. La molécule résultante possède un groupe hémiacétal ou hémikétal, selon que la forme linéaire était un aldose ou un cétose. La réaction est facilement inversée, donnant la forme originale à chaîne ouverte.
Dans ces formes cycliques, le cycle comporte généralement cinq ou six atomes. Ces formes sont appelées respectivement furanoses et pyranoses – par analogie avec le furane et le pyrane, les composés les plus simples possédant le même cycle carbone-oxygène (bien qu’il leur manque les doubles liaisons de ces deux molécules). Par exemple, l’aldohexose glucose peut former une liaison hémiacétal entre l’hydroxyle du carbone 1 et l’oxygène du carbone 4, ce qui donne une molécule avec un cycle à 5 chaînons, appelée glucofuranose. La même réaction peut avoir lieu entre les carbones 1 et 5 pour former une molécule avec un cycle à 6 chaînons, appelée glucopyranose. Les formes cycliques avec un cycle à sept atomes (le même de l’oxépane), rarement rencontrées, sont appelées heptoses.


.
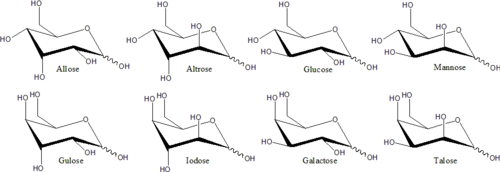
Pour de nombreux monosaccharides (dont le glucose), les formes cycliques prédominent, à l’état solide et en solution, et on utilise donc couramment le même nom pour les isomères à chaîne ouverte et à chaîne fermée. Ainsi, par exemple, le terme « glucose » peut signifier le glucofuranose, le glucopyranose, la forme à chaîne ouverte ou un mélange des trois.
La cyclisation crée un nouveau centre stéréogénique au niveau du carbone porteur de carbonyle. Le groupe -OH qui remplace l’oxygène du carbonyle peut se retrouver dans deux positions distinctes par rapport au plan médian du cycle. Ainsi, chaque monosaccharide à chaîne ouverte donne deux isomères cycliques (anomères), désignés par les préfixes α- et β-. La molécule peut passer d’une forme à l’autre par un processus appelé mutarotation, qui consiste en une inversion de la réaction de formation du cycle suivie d’une autre formation de cycle.
Projection HaworthEdit
La structure stéréochimique d’un monosaccharide cyclique peut être représentée par une projection Haworth. Dans ce diagramme, l’isomère α pour la forme pyranose d’un D-aldohexose a le -OH du carbone anomérique sous le plan des atomes de carbone, tandis que l’isomère β a le -OH du carbone anomérique au-dessus du plan. Les pyranoses adoptent généralement une conformation chaise, similaire à celle du cyclohexane. Dans cette conformation, l’isomère α a le -OH du carbone anomérique en position axiale, tandis que l’isomère β a le -OH du carbone anomérique en position équatoriale (en considérant les sucres D-aldohexose).
-
α-D-…Glucopyranose
-
β-D-Glucopyranose
.