Pneumonie nosocomiale
(Ce chapitre a été reproduit avec l’autorisation de Williams MV, Hayward R : Comprehensive Hospital Medicine, 1ère édition. Philadelphie, WB Saunders, sous presse.)
Contexte
La pneumonie nosocomiale (PN) est la principale cause de mortalité parmi les patients qui décèdent d’une infection nosocomiale. Définie comme une pneumonie survenant 48 heures ou plus après l’admission à l’hôpital, la NP comprend également le sous-ensemble des pneumonies sous ventilation mécanique (PVA), définies comme des pneumonies se développant 48 à 72 heures après le début de la ventilation mécanique. L’incidence de la PN se situe entre 5 et 15 cas pour 1000 admissions à l’hôpital. La pneumonie associée aux soins (PAS), qui fait partie du continuum des PN, décrit une proportion de plus en plus courante de pneumonies se développant en dehors de l’hôpital (tableau I) (1). Affectant généralement les personnes vivant dans une maison de soins ou une résidence assistée, ces patients sont à risque de contracter des organismes résistants aux antibiotiques et doivent être abordés de la même manière que les cas de pneumonie nosocomiale plutôt que de pneumonie acquise dans la communauté. La plupart des données qui éclairent nos décisions diagnostiques et thérapeutiques concernant les PN proviennent d’études réalisées chez des patients ventilés mécaniquement et sont extrapolées pour formuler des recommandations pour les patients non ventilés.
La mortalité attribuable aux PN est débattue, mais pourrait atteindre 30 %. La présence d’une pneumonie nosocomiale augmente la durée de séjour à l’hôpital de 7 à 10 jours en moyenne et, dans le cas de la PVA, son coût est estimé entre 10 000 et 40 000 dollars par cas (2).
Évaluation
Présentation clinique
Signes et symptômes
La pneumonie nosocomiale est généralement diagnostiquée sur des bases cliniques. Les symptômes et les signes typiques consistent en une fièvre, une toux avec expectoration et un essoufflement dans le cadre d’une hypoxie et d’un nouvel infiltrat sur la radiographie pulmonaire (CXR). Chez les personnes âgées, les signes peuvent être plus subtils et le délire, la fièvre ou la leucocytose en l’absence de toux doivent faire envisager le diagnostic. La probabilité de NP augmente chez les patients présentant des facteurs de risque de microaspiration, de colonisation oropharyngée ou de surcroissance d’organismes résistants (tableau II) (3).
Diagnostic différentiel
Avant de se fixer sur un diagnostic de NP, il faut envisager d’autres causes de fièvre, d’hypoxie et d’infiltrats pulmonaires. Le plus souvent, il s’agit d’une embolie pulmonaire, d’un œdème pulmonaire ou d’une atélectasie. Les sources infectieuses alternatives, telles que les infections des voies urinaires, de la peau et des tissus mous, et les infections liées à des dispositifs (c’est-à-dire les cathéters veineux centraux) sont fréquentes chez les patients hospitalisés et doivent être écartées avant de diagnostiquer une pneumonie nosocomiale.
 click for large version
click for large version
click for large version
Diagnostic
Les stratégies diagnostiques de la PN cherchent à confirmer le diagnostic et à identifier un pathogène étiologique, permettant ainsi une antibiothérapie rapide, efficace et rationalisée. Malheureusement, il n’existe pas de consensus sur la meilleure approche pour diagnostiquer une pneumonie nosocomiale. Après avoir obtenu un hémogramme complet et des hémocultures, vous pouvez choisir entre une approche de diagnostic clinique ou microbiologique. Un diagnostic clinique repose sur un infiltrat radiographique nouveau ou progressif ainsi que sur des signes d’infection tels que la fièvre, la leucocytose ou des expectorations purulentes. Le diagnostic clinique est sensible, mais il est susceptible d’entraîner une surconsommation d’antibiotiques. L’approche microbiologique nécessite un prélèvement des sécrétions des voies respiratoires et peut réduire l’utilisation inappropriée d’antibiotiques, mais prend plus de temps et n’est pas forcément disponible dans tous les hôpitaux.
Etudes préférées
L’approche microbiologique du diagnostic repose sur l’utilisation de cultures quantitatives ou semi-quantitatives pour créer des seuils de traitement antibiotique. Les cultures bactériennes qui démontrent un niveau de croissance supérieur aux seuils décrits ci-dessous justifient un traitement, tandis que celles qui sont inférieures doivent déclencher la retenue ou l’arrêt des antibiotiques.
Approches bronchoscopiques : Le lavage broncho-alvéolaire (LBA) avec un seuil de 10 (4) organismes/mL ou la brosse à spécimen protégée (BPS) avec un seuil de 10 (3) organismes/mL sont considérés comme les tests diagnostiques les plus spécifiques lorsqu’ils sont réalisés avant d’initier des antibiotiques, ou avant de changer d’antibiotiques si un patient en reçoit déjà. Chez les patients cliniquement stables, les antibiotiques peuvent être interrompus en toute sécurité si la croissance bactérienne tombe en dessous des seuils. Si les cultures sont positives, l’antibiothérapie doit être adaptée pour cibler l’organisme identifié. L’approche bronchoscopique est privilégiée chez les patients sous ventilation mécanique, qui développent leur pneumonie tard dans le séjour hospitalier (>5-7 jours), qui sont à risque de pathogènes inhabituels, qui échouent dans leur traitement ou qui sont suspectés d’avoir un autre diagnostic.
Approches non bronchoscopiques : Les aspirations endotrachéales qualitatives (ETA) se sont révélées assez sensibles chez les patients ventilés, identifient régulièrement des organismes qui peuvent être trouvés ultérieurement par LBA ou PSB et, si elles sont négatives, doivent conduire à ne pas administrer d’antibiotiques. Les aspirations endotrachéales quantitatives avec un seuil de 10 (6) organismes/mL sont souvent encouragées pour réduire la surconsommation d’antibiotiques, mais les résultats doivent être interprétés avec prudence car ils n’ont qu’une sensibilité et une spécificité d’environ 75 % (1). Il faut envisager de ne pas administrer d’antibiotiques à un patient cliniquement stable présentant une ETA quantitative négative si les antibiotiques n’ont pas été changés dans les 72 heures précédentes. De nombreuses unités de soins intensifs ont commencé à effectuer des prélèvements en aveugle des sécrétions des voies respiratoires inférieures à l’aide de cathéters d’aspiration (PSB en aveugle, mini-BAL en aveugle). Ces techniques peuvent être réalisées à toute heure par des inhalothérapeutes ou des infirmiers formés, fournissent des données de culture similaires à celles de la bronchoscopie, et peuvent être plus sûres et moins coûteuses que la bronchoscopie. En général, les techniques non-bronchoscopiques sont préférables chez les patients qui ne sont pas sous ventilation mécanique. Le prélèvement d’expectorations, bien que facile à obtenir, n’a pas été bien étudié chez les PN. Cependant, chez les patients chez qui les techniques bronchoscopiques ou autres techniques non bronchoscopiques ne sont pas réalisables, un prélèvement d’expectoration peut être effectué pour identifier les organismes potentiellement résistants et aider à adapter le traitement.
Options alternatives
Score d’infection pulmonaire clinique-Combinaison des approches cliniques et microbiologiques
Le diagnostic clinique de pneumonie nosocomiale (nouvel infiltrat + fièvre, leucocytose ou expectoration purulente) conduit probablement à une surconsommation d’antibiotiques, or la poursuite d’un diagnostic bronchoscopique est invasive, coûteuse et nécessite une expertise technique. L’ETA quantitative, la PSB en aveugle et le LBA en aveugle discutés ci-dessus sont des exemples de certains compromis qui évitent la nécessité d’une bronchoscopie, mais ajoutent des données microbiologiques dans le but de prévenir une antibiothérapie excessive. Il peut également être utile de combiner formellement les approches diagnostiques (clinique + microbiologique). L’une de ces options est l’utilisation du score clinique d’infection pulmonaire (CPIS), qui combine des données cliniques, radiographiques, physiologiques et microbiologiques en un résultat numérique. Il a été démontré que les scores >6 présentent une bonne corrélation avec le LBA quantitatif (4). Des études plus récentes ont cependant suggéré une spécificité plus faible qui pourrait encore entraîner une surconsommation d’antibiotiques, mais cette approche reste plus précise qu’une approche clinique générale. Il peut être plus utile d’utiliser le CPIS en série au moment de la suspicion de NP et à nouveau après 72 heures. Chez les patients pour lesquels on soupçonne initialement une pneumonie (CPIS de 6 ou moins), les antibiotiques pourraient être interrompus en toute sécurité après 72 heures si le CPIS reste faible (5). Une telle stratégie peut être utile dans les milieux où des modalités de diagnostic plus sophistiquées ne sont pas disponibles.
De multiples études sur les marqueurs biologiques de l’infection ont tenté de trouver un moyen non invasif, rapide et précis de déterminer qui a besoin d’antibiotiques pour une PN présumée. Malheureusement, les résultats ont été largement décevants. Plus récemment, il a été démontré que la mesure d’un récepteur soluble déclencheur exprimé sur les cellules myéloïdes (sTREM-1), qui est régulé à la hausse dans le cadre d’une infection, améliore notre capacité à diagnostiquer les NP avec précision. La mesure du sTREM-1 était sensible à 98 % et spécifique à 90 % pour le diagnostic de la pneumonie chez les patients sous ventilation mécanique (6). Bien que prometteur, davantage de données sont nécessaires avant que ce test puisse être recommandé pour une utilisation de routine.
Management
Traitement initial
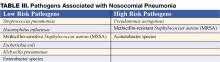
L’initiation précoce d’une antibiothérapie empirique adéquate (c’est-à-dire que les antibiotiques administrés se révèlent actifs contre tous les organismes isolés) est associée à une meilleure survie par rapport à un traitement initial inadéquat (1,7). Les antibiotiques doivent être commencés immédiatement après l’obtention d’échantillons de sang et d’expectoration pour la culture et ne doivent pas être retenus en cas de retard dans les tests diagnostiques. La nécessité de choisir les antibiotiques rapidement et promptement conduit à l’utilisation d’antibiotiques à large spectre. Afin d’éviter une surconsommation inutile d’antibiotiques à large spectre, le traitement doit être basé sur le risque de pathogènes multirésistants (MDR). L’identification des patients à faible risque d’agents pathogènes multirésistants par des critères cliniques permet une antibiothérapie plus restreinte, mais efficace. Les patients à faible risque comprennent ceux qui développent leur pneumonie au début de l’hospitalisation (<5-7 jours), ne sont pas immunodéprimés, n’ont pas reçu d’antibiotiques à large spectre auparavant et ne présentent pas de facteurs de risque de PCHA (tableau I) (1,7). Chez ces patients, les antibiotiques doivent cibler les organismes communautaires courants (tableau III – pathogènes à faible risque). L’antibiothérapie initiale appropriée pourrait inclure une céphalosporine de troisième génération ou une bêta-lactamine/inhibiteur de bêta-lactamase. Dans certaines communautés ou services hospitaliers, l’incidence de la résistance à la méthicilline parmi les isolats de Staphylococcus aureus (SARM) peut être suffisamment élevée pour justifier un traitement empirique initial par vancomycine ou linézolide.
 cliquez pour la version large
cliquez pour la version large
cliquez pour la version large
Malheureusement, les patients hospitalisés d’aujourd’hui, de plus en plus complexes, ont peu de chances d’être » à faible risque « , surtout dans les unités de soins intensifs.
Les patients ne répondant pas aux critères de faible risque sont considérés comme étant à haut risque pour les pathogènes MDR (tableau III-pathogènes à haut risque). Le traitement empirique initial doit être large et inclure un agent antipseudomonal (céfépime ou imipénème ou bêta-lactame/inhibiteur de bêta-lactamase) plus une fluoroquinolone ou un aminoglycoside plus vancomycine ou linezolid. Le traitement empirique initial spécifique doit être dicté par les schémas de résistance locaux, le coût et la disponibilité des agents préférés. Lorsqu’un tel traitement à large spectre est mis en place, il devient impératif de procéder à une « désescalade » des antibiotiques afin de limiter leur surconsommation. La thérapie de désescalade se concentre sur la réduction du spectre d’antibiotiques en fonction des résultats des cultures et sur la limitation de la durée globale du traitement. Les hospitaliers devraient viser à accomplir cette désescalade dans les 48 à 72 heures suivant l’instauration d’une antibiothérapie à large spectre.
 click for large version
click for large version
click for large version
Traitement subséquent
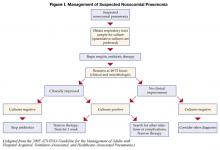
Les patients commencés sous antibiothérapie empirique initiale pour une pneumonie nosocomiale présumée doivent être réévalués à 48-72 heures. Plus précisément, les cultures doivent être vérifiées et la réponse clinique au traitement évaluée. La figure I décrit un algorithme pour guider le traitement (1). Chez les patients qui sont cliniquement stables et dont les cultures des voies respiratoires inférieures sont négatives, on peut arrêter les antibiotiques. Les patients dont les cultures sont positives doivent bénéficier d’une antibiothérapie adaptée, ou « désescaladée », en fonction des organismes identifiés. En général, il faut utiliser l’antibiotique à spectre le plus étroit qui est actif contre les bactéries isolées. L’utilisation d’une thérapie combinée pour les organismes gram négatifs (deux antibiotiques ou plus actifs contre un isolat bactérien) est largement pratiquée pour obtenir une synergie ou prévenir le développement de la résistance. Cependant, en l’absence de neutropénie, il n’a pas été démontré que la thérapie combinée était supérieure à la monothérapie (8), et la monothérapie est préférable. L’isolement du SARM à partir d’un échantillon respiratoire devrait également entraîner l’utilisation de la monothérapie. Bien que certaines études aient suggéré que le linézolide pourrait être supérieur à la vancomycine pour la pneumonie à SARM, cette constatation doit être validée par des études prospectives.
Un deuxième élément de la désescalade consiste à raccourcir la durée totale du traitement. Le CPIS peut être utilisé pour raccourcir la durée de la thérapie chez les patients à faible risque de pneumonie. Des chercheurs d’un centre médical des Anciens Combattants ont randomisé des patients soupçonnés d’être atteints de PN, mais dont le score CPIS < 6, pour qu’ils reçoivent soit un traitement de 10 à 21 jours, soit un traitement de courte durée. Les patients recevant un traitement de courte durée ont été réévalués au jour 3, et si leur score CPIS restait < 6, les antibiotiques étaient arrêtés (5). Le groupe recevant le traitement court n’avait pas de différence de mortalité par rapport au groupe recevant le traitement standard, mais il utilisait moins d’antibiotiques, séjournait moins longtemps en soins intensifs et était moins susceptible de développer une surinfection ou une infection par un organisme résistant. Si le CPIS n’est pas utilisé, ou si l’on estime que les patients présentent un risque plus élevé ou s’il est démontré de manière convaincante qu’ils sont atteints de NP, un traitement plus court peut toujours être préféré. Un vaste essai randomisé a montré qu’une antibiothérapie de 8 jours pour les patients atteints de PVA donnait des résultats cliniques similaires à une antibiothérapie de 15 jours. En outre, une antibiothérapie de courte durée était associée à une probabilité moindre de développer des infections ultérieures par des agents pathogènes multirésistants. Un sous-ensemble de patients du groupe de traitement de 8 jours infectés par des bacilles gram négatifs non fermentaires (par exemple, Pseudomonas aeruginosa) a bien présenté un taux de récidive d’infection pulmonaire plus élevé, mais en raison d’une surveillance agressive, cela ne s’est pas traduit par un risque de mortalité plus élevé dans ce sous-ensemble de patients (9).
En résumé, le traitement des patients présentant une suspicion de PN commence par l’initiation immédiate d’antibiotiques et le prélèvement de sécrétions respiratoires. Si les patients à faible risque peuvent recevoir un traitement à spectre plus étroit, la plupart des patients auront besoin d’un traitement empirique initial large. Le régime antibiotique doit toutefois être réduit après 48-72 heures en fonction des résultats microbiologiques si l’état du patient s’améliore. Une durée de traitement globale d’une semaine est sûre et efficace, avec moins de risques de favoriser la croissance d’organismes résistants. Dans le sous-ensemble de patients souffrant d’infections pseudo-monales, le traitement d’une durée d’une semaine doit être suivi d’une surveillance active pour la récurrence, ou alternativement, le traitement peut être étendu à deux semaines.
Prognostic
Une fois que le traitement pour les NP est initié, une amélioration clinique est généralement observée dans les 48-72 heures. Il y a peu de soutien pour suivre soit la réponse microbiologique (élimination des cultures positives), soit la réponse par la radiographie pulmonaire. La radiographie pulmonaire est souvent en retard sur la réponse clinique, cependant, une aggravation marquée du CXR (>50% d’augmentation de l’infiltrat) dans les 48 premières heures peut indiquer un échec du traitement. La résolution clinique, mesurée par la température, le nombre de globules blancs et l’oxygénation, survient généralement au bout de 6 à 7 jours (10). Il a été démontré que l’absence d’amélioration de l’oxygénation au bout de 72 heures est un facteur prédictif de l’échec du traitement.
La mortalité globale chez les patients atteints de NP atteint 30 à 70 %, en grande partie en raison de maladies comorbides graves dans la population à risque. Des taux de mortalité plus élevés sont observés chez les patients présentant une PVA et des organismes résistants. La mortalité attribuable à l’épisode de PN est d’environ 30%, et peut être réduite à < 15% avec une antibiothérapie appropriée (1).
Prévention
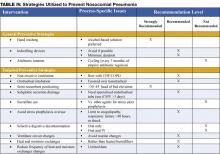
Les stratégies préventives visent soit à réduire l’incidence globale des complications infectieuses chez les patients hospitalisés, soit à réduire spécifiquement l’incidence des pneumonies nosocomiales (3). La majorité des données soutenant les stratégies préventives se limitent aux patients de l’unité de soins intensifs, et en particulier aux patients sous ventilation mécanique. Cependant, bon nombre des principes préventifs peuvent être extrapolés à la population hors USI. Les stratégies préventives sont mises en évidence dans le tableau IV (page 18).
Stratégies préventives générales
Les stratégies préventives générales visent à éviter la contamination des patients par des organismes résistants aux antimicrobiens qui existent dans les hôpitaux, ou à atténuer l’émergence d’organismes résistants aux antimicrobiens en premier lieu. La prévention de la propagation iatrogène d’organismes résistants dépend d’une hygiène des mains soigneuse. Le lavage des mains avant et après le contact avec le patient réduit l’incidence des infections nosocomiales. Les rince-mains à base d’alcool placés au chevet du patient peuvent en fait être supérieurs au savon et à l’eau et, en outre, améliorer la conformité à l’hygiène des mains.
Minimiser l’utilisation de dispositifs à demeure (cathéters centraux, cathéters urinaires) réduit également l’émergence d’organismes résistants. Lorsque ces dispositifs sont nécessaires, il est essentiel de se concentrer sur leur retrait en temps opportun. Le contrôle de l’utilisation des antibiotiques a été au cœur de nombreuses stratégies de prévention. L’utilisation prolongée ou inutile d’antibiotiques à large spectre est fortement associée au développement et à la colonisation d’organismes résistants. Les stratégies axées sur une désescalade agressive des antibiotiques (décrites ci-dessus) constituent un outil de prévention essentiel. Certains établissements ont eu du succès avec la restriction ou la rotation des antibiotiques, mais on manque de données à long terme sur l’efficacité de ces techniques.
 cliquer pour la version large
cliquer pour la version large
cliquer pour la version large
Stratégies préventives ciblées
.
Les stratégies préventives visant à diminuer l’incidence des PN se concentrent sur la réduction des facteurs de risque de colonisation oropharyngée ou gastrique et d’aspiration ultérieure de sécrétions oropharyngées ou gastriques contaminées (1,3,7,11).
L’intubation endotrachéale est l’un des plus importants facteurs de risque de NP chez les patients nécessitant une assistance ventilatoire. L’utilisation de la ventilation non invasive (VNI) ou de la ventilation au masque à pression positive chez des groupes de patients sélectionnés s’est avérée efficace pour prévenir les pneumonies nosocomiales. La ventilation non invasive s’est avérée la plus efficace chez les patients souffrant d’exacerbations aiguës de la bronchopneumopathie chronique obstructive (BPCO) et d’œdème pulmonaire secondaire à une insuffisance cardiaque congestive (ICC) et doit être envisagée chez des patients sélectionnés de manière appropriée. Lorsque l’intubation est nécessaire, l’utilisation de l’intubation nasotrachéale doit être évitée en raison de taux plus élevés de NP par rapport à l’intubation orotrachéale.
Le positionnement en position couchée peut contribuer au développement de la NP, probablement en raison d’un risque accru de reflux gastrique et d’aspiration ultérieure. Les études sur le positionnement semi-allongé (élévation de la tête du lit >45 degrés) ont montré moins de reflux, moins d’aspiration et, dans un récent essai comparatif randomisé, une réduction significative du taux de PVA (12). L’élévation de la tête du lit est clairement indiquée chez les patients sous ventilation mécanique et est également susceptible d’être bénéfique pour tous les patients à risque d’aspiration et de PN subséquente, bien que cette technique n’ait pas été bien étudiée chez les patients non ventilés.
Le drainage des sécrétions sous-glottiques (DSS) implique l’élimination des sécrétions regroupées au-dessus du brassard d’une sonde endotrachéale spécialisée qui pourrait autrement fuir dans le poumon. Une méta-analyse de cinq études évaluant cette nouvelle technologie a montré une réduction significative de l’incidence de la PVA. L’utilisation de la SSD devrait être envisagée chez les patients nécessitant plus de 3 jours de ventilation mécanique (13).
Les médicaments utilisés pour la prophylaxie de l’ulcère de stress qui augmentent le pH gastrique – tels que les antagonistes H2 et les antiacides – permettent la colonisation du tractus gastro-intestinal supérieur par des organismes potentiellement pathogènes et augmentent donc le risque de PN. On estime que l’utilisation du sucralfate au lieu des antagonistes H2 entraîne une moindre alcalinisation de l’estomac et une moindre prolifération bactérienne. La capacité du sucralfate à prévenir les pneumonies nosocomiales n’a cependant pas été bien démontrée et son utilisation systématique n’est pas recommandée (14). Les efforts devraient plutôt viser à limiter l’utilisation de la prophylaxie de l’ulcère de stress aux populations à haut risque d’hémorragie cliniquement significative, à savoir les patients souffrant de coagulopathie et d’insuffisance ventilatoire prolongée. La plupart des patients qui ne sont pas aux soins intensifs ne devraient pas recevoir de prophylaxie de l’ulcère de stress. Le risque de NP lié à l’utilisation d’inhibiteurs de la pompe à protons n’a pas été bien étudié.
La décontamination digestive sélective (DDS) implique la stérilisation de l’oropharynx et du tractus gastro-intestinal chez les patients sous ventilation mécanique afin de prévenir l’aspiration d’un grand nombre d’organismes potentiellement pathogènes et la PVA subséquente. La plupart des évaluations du SDD ont impliqué l’application orale (et parfois gastrique) de polymixine topique, d’aminoglycoside et d’amphotéricine. Dans de nombreux cas, de courtes cures d’antibiotiques IV ont été ajoutées. Au moins 10 méta-analyses ont montré une réduction du risque de PVA avec l’utilisation du SDD. L’ajout d’antibiotiques IV peut également apporter un bénéfice en termes de mortalité. Cependant, le risque à long terme d’émergence d’organismes résistants et l’insuffisance des données sur le rapport coût-efficacité du SDD empêchent sa recommandation pour une utilisation systématique (14).
Il existe plusieurs stratégies préventives ciblées sur la réduction de l’aspiration des contaminants dans les circuits, les filtres et les tubulures des ventilateurs. Les stratégies recommandées, énumérées dans le tableau III, page 16, comprennent l’évitement des changements de circuit de ventilateur de routine (changer la tubulure uniquement lorsqu’elle est visiblement contaminée ou pour un nouveau patient), l’utilisation d’échangeurs de chaleur et d’humidité plutôt que d’humidificateurs chauffants, et la réduction de la fréquence des changements des échangeurs de chaleur et d’humidité (1,11,14).
Plans de sortie/suivi
Les patients doivent être suivis à l’hôpital jusqu’à ce qu’il soit clair qu’ils répondent au traitement et que leur état clinique s’améliore. L’évaluation des stratégies visant à faire passer rapidement les patients à un traitement oral a été limitée. Cependant, si les patients s’améliorent, tolèrent le traitement oral, ont un tube digestif fonctionnel et ont un organisme isolé qui est sensible aux antibiotiques oraux disponibles, le passage au traitement oral peut être effectué. Si aucun organisme n’est isolé, mais que l’on estime que le patient est atteint de NP, les antibiotiques oraux choisis doivent avoir le même spectre d’activité que les antibiotiques IV précédemment administrés. Dans de nombreux cas, les patients présentent une infection par un organisme qui n’est sensible qu’aux antibiotiques IV. Ces patients sont susceptibles d’être suffisamment malades pour suivre un traitement IV complet d’une semaine à l’hôpital, mais s’ils n’ont pas de maladie comorbide active et que leur état s’est amélioré, ils peuvent se faire poser un cathéter PICC (ou un autre accès IV à long terme) et recevoir le reste de leur traitement à domicile ou dans un autre établissement de moindre acuité.
Chez tous les patients qui développent une PN, les causes réversibles d’aspiration doivent être recherchées, et dans les cas où des organismes multirésistants sont isolés, cela doit être signalé à tout établissement vers lequel un patient est transféré ou au médecin de soins primaires ou à l’infirmière à domicile qui assumera les soins après la sortie.
- Lignes directrices pour la gestion des adultes atteints de pneumonie acquise à l’hôpital, associée au ventilateur et associée aux soins. Am J Respir Crit Care Med. 2005;171:388-416.
- Warren DK, Shukla SJ, Olsen MA, et al. Outcome and attributable cost of ventilator-associated pneumonia among intensive care unit patients in a suburban medical center. Crit Care Med. 2003;31:1312-7.
- Flanders SA, Collard HR, Saint S. Preventing Nosocomial Pneumonia. In : Lautenbach E, Woeltje K, eds. The Society for Healthcare Epidemiology of America : Practical Handbook for Healthcare Epidemiologists. Thorofare, NJ : Slack, 2004:69-78.
- Pugin J, Auckenthaler R, Mili N, Janssens JP, Lew PD, Suter PM. Diagnostic de la pneumonie associée aux ventilateurs par l’analyse bactériologique du liquide de lavage broncho-alvéolaire « aveugle » bronchoscopique et non-bronchoscopique. Am Rev Respir Dis. 1991;143:1121-9.
- Singh N, Rogers P, Atwood CW, Wagener MM, Yu VL. Antibiothérapie empirique de courte durée pour les patients présentant des infiltrats pulmonaires dans l’unité de soins intensifs. A proposed solution for indiscriminate antibiotic prescription. Am J Respir Crit Care Med. 2000;162:505-11.
- Gibot S, Cravoisy A, Levy B, Bene MC, Faure G, Bollaert PE. Récepteur soluble déclencheur exprimé sur les cellules myéloïdes et le diagnostic de la pneumonie. N Engl J Med. 2004;350:451-8.
- Chastre J, Fagon JY. La pneumonie sous ventilation assistée. Am J Respir Crit Care Med. 2002;165:867-903.
- Paul M, Benuri-Silbiger I, Soares-Weiser K, Leibovici L. Beta lactam monothérapie versus beta lactam-aminoglycoside combination therapy for sepsis in immunocompetent patients : systematic review and metaanalysis of randomised trials. BMJ. 2004;328:668.
- Chastre J, Wolff M, Fagon JY, et al. Comparaison de 8 vs 15 jours d’antibiothérapie pour la pneumonie sous ventilation assistée chez l’adulte : un essai randomisé. JAMA. 2003;290:2588-98.
- Dennesen PJ, van der Ven AJ, Kessels AG, Ramsay G, Bonten MJ. Résolution des paramètres infectieux après un traitement antimicrobien chez les patients atteints de pneumonie sous ventilation assistée. Am J Respir Crit Care Med. 2001;163:1371-5.
- Collard HR, Saint S, Matthay MA. Prévention de la pneumonie associée au ventilateur : une revue systématique fondée sur des preuves. Ann Intern Med. 2003;138:494-501.
- Drakulovic MB, Torres A, Bauer TT, Nicolas JM, Nogue S, Ferrer M. Supine body position as a risk factor for nosocomial pneumonia in mechanically ventilated patients : a randomised trial. Lancet. 1999;354:1851-8.
- Dezfulian C, Shojania K, Collard HR, Kim HM, Matthay MA, Saint S. Subglottic secretion drainage for preventing ventilator-associated pneumonia : a metaanalysis. Am J Med. 2005;118:11-8.
- Dodek P, Keenan S, Cook D, et al. Guide de pratique clinique fondé sur des données probantes pour la prévention de la pneumonie sous ventilation assistée. Ann Intern Med. 2004;141:305-13.