Biologia Cellulare 07: Microtubuli e Divisione Cellulare
Queste sono le note della lezione 7 del corso di Biologia Cellulare di Harvard Extension.
La lezione 6 ha introdotto i microtubuli, e questa lezione discuterà il loro ruolo nella divisione cellulare. Ecco un video introduttivo:
Panoramica del ciclo cellulare
Il ciclo cellulare – il processo di divisione e replicazione cellulare – è governato da una serie di interruttori biochimici chiamati sistema di controllo del ciclo cellulare.
Il ciclo cellulare è diviso in fasi che sono divise in fasi – la gente farà riferimento alle “4 fasi” ma in realtà ce ne sono 5, e la gente usa anche altre parole per raggruppare queste fasi insieme, e altre parole per suddividerle. Ho fatto del mio meglio per riassumere la relazione tra questi termini nella seguente tabella. (modificato/espanso da Wikipedia):
| Raggruppamento più generale | le presunte “4 fasi” | sottofasi |
|---|---|---|
| non-dividendo | Gap 0 (G0) | |
| interfase | Gap 1 (G1) | G1a R G1b |
| Sintesi (S) | ||
| Gap 2 (G2) | ||
| Mitosi | Mitosi (M) | profase prometafase metafase anafase telofase citochinesi |
Il contenuto di ogni fase è splendidamente riassunto in questa eccezionale immagine Wikimedia Commons di Kelvinsong:

Le cellule umane che si dividono più velocemente possono completare un ciclo cellulare in circa 24 ore (G1: 9h, S: 10h, G2: 4h, M: 30 min). Il lievito può finire un ciclo in 30 minuti, e le cellule di Drosophila che si dividono più velocemente impiegano solo 8 minuti.
I controllori principali di questo processo includono le cicline, che regolano la chinasi ciclina-dipendente o CDK. Ricordiamo che le chinasi sono proteine che fosforilano altre proteine. La fosforilazione della CDK dei suoi bersagli permette alla mitosi di procedere. Per essere precisi, il fattore di promozione della maturazione o MPF è un complesso eterodimero obbligato composto da ciclina B e CDK, che svolge la sua azione fosforilante solo quando sono presenti entrambe le proteine.
Ruolo dei microtubuli
I microtubuli sono fondamentali in tutto il ciclo cellulare: organizzano i componenti cellulari e li dividono in due. Ecco una serie di video del ciclo cellulare che evidenziano il ruolo dei microtubuli:
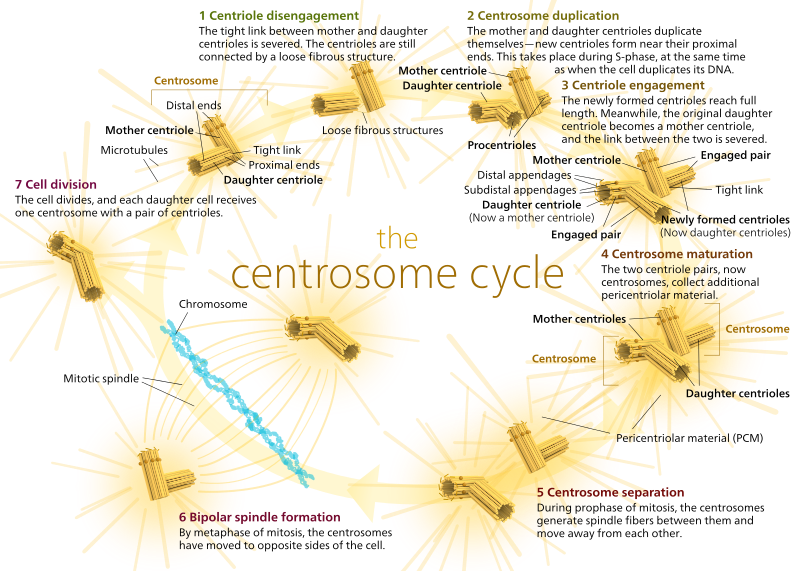
Negli animali, le cellule quiescenti e anche le cellule in interfase hanno di solito un solo centrosoma, chiamato centrosoma, che serve come hub centrale per tutti i microtubuli nella cellula. Un centrosoma è composto da due centrioli come mostrato qui sotto (grazie ancora a Kelvinsong):

I due centrioli si staccano l’uno dall’altro e si replicano durante la fase S, e poi si separano per formare “poli” opposti della cellula durante la fase M, così che ora ci sono due MTOC, ognuno dei quali sarà alla fine l’unico MTOC di una nuova cellula (un’altra immagine del capo Kelvinsong):
Durante la mitosi, poi, si hanno i due “poli” della cellula, ciascuno con microtubuli ancorati all’estremità (-) e con le loro estremità (+) sovrapposte, che puntano al centro della cellula, come mostrato qui (immagine Wikimedia Commons di Lordjuppiter):
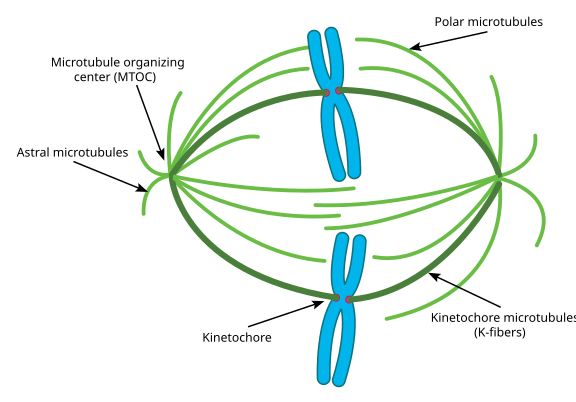
Tutto questo è chiamato apparato del fuso, e l’area dove i microtubuli delle due MTOC si sovrappongono è chiamata “zona di interdigitazione”. A volte si sente dire che ogni MTOC e la sua serie di microtubuli a forma di riccio sono chiamati “aster mitotici”.
I microtubuli in questa fase si dividono in tre categorie:
- I microtubuli astrali puntano verso l’esterno, verso la corteccia cellulare, per ancorare l’intero apparato mandrino lungo l’asse della divisione cellulare.
- I microtubuli del cinetocoro si attaccano al cinetocoro dei cromatidi.
- I microtubuli polari, orientati parallelamente ma in direzioni opposte, sono cruciali per spingere l’apparato del fuso durante la mitosi. (In effetti, i microtubuli polari sono presenti anche prima e aiutano a spingere i centrosomi durante la profase).
Se preferisci le foto ai diagrammi, ecco come appare l’intero apparato del fuso, con i cromatidi in blu, i microtubuli in verde e i cinetocori come punti rossi:

I microtubuli diventano molto più dinamici durante la mitosi: più gamma-tubulina promuove una nucleazione più facile, ma XMAP215, uno stabilizzatore di microtubuli, viene fosforilato e quindi inattivato durante la mitosi, lasciando Kinesina-13 libera di catastrofizzare i microtubuli. Le fortune sono fatte e perse rapidamente. L’emivita di un microtubulo durante la mitosi è di circa 15 minuti, rispetto ai 30 minuti durante l’interfase. La gente studia la dinamica dei microtubuli usando la FRAP: si aggiunge un microtubulo fluorescente, lo si sbianca e si vede quanto velocemente avviene il riassemblaggio in base a quanto presto riappare la fluorescenza. +Anche le punte giocano un ruolo importante nell’aiutare e assemblare i microtubuli.
Kinesina-5 ha due teste polari che si legano a microtubuli opposti e cercano di camminare verso l’estremità (+) di ciascuno. Questo spinge i due microtubuli a parte e fornisce la forza motrice per la separazione delle MTOC.
Il DNA centromerico ha una bassa entropia informativa e istoni speciali che differiscono dalle altre cromatine. I centromeri sono una parte del genoma che non si raccoglie quasi mai nel sequenziamento next-gen, anche ad alta profondità. Questo perché i centromeri servono uno scopo diverso rispetto a gran parte del resto del genoma: la sequenza lì è favorevole all’interazione con le proteine centromeriche e all’attacco del cinetocoro. Le coesine sono proteine che tengono insieme i due cromatidi fratelli. Ci riferiremo alle proteine del cinetocoro come se avessero due strati, il cinetocoro interno e il cinetocoro esterno.
Durante la prometafase, i cromosomi si muovono avanti e indietro. Le chinesine ancorano i cromosomi ai microtubuli del cinetocoro oltre la punta, dove la chinesina-13 sta depolimerizzando i microtubuli, aiutata da una carenza di dimeri di tubulina disponibili. Una combinazione di proteine motrici, proteine interagenti con i microtubuli e treadmilling serve a spostare i cromosomi. Nel frattempo, la dineina e la dinactina – proteine motrici che camminano verso l’estremità (-) – lavorano sui microtubuli astrali, tirando le MTOC verso la periferia della cellula. In metafase, i cromatidi vengono allineati lungo la “piastra di metafase”.
Durante questo processo l’involucro nucleare si dissolve e quindi l’importazione nucleare diventa irrilevante. Ran-GEF si localizza vicino ai cromosomi e genera alte concentrazioni di Ran-GTP che fornisce energia per alcuni processi necessari (?).
Le cellule hanno qualche meccanismo per rilevare la tensione nei microtubuli che indica i cromatidi attaccati prima che la mitosi possa procedere. Assicurarsi che ogni cromatide sia correttamente ancorato è fondamentale per evitare l’aneuploidia.
A proposito, anche altri elementi citoscheletrici oltre ai microtubuli giocano un ruolo chiave nel ciclo cellulare. Nella citochinesi, l’actina forma un anello contrattile e, con l’aiuto delle proteine motorie miosina II, stringe la cellula in due.
Importanza degli organismi modello
La scoperta dei processi di regolazione del ciclo cellulare si è basata molto su alcune caratteristiche chiare di organismi modello popolari.
Saccharomyces cerevisiae (lievito in erba) e Schizosaccharomyces pombe (lievito da fissione) possono esistere come aploidi o diploidi. Questo è importante perché nella fase aploide, una mutazione può eliminare un gene – non è necessario colpire entrambi gli alleli. E nel lievito, molte mutazioni, specialmente nei geni Cdc__ (controllo della divisione cellulare), sono dipendenti dalla temperatura, dove una proteina con una mutazione missenso può ancora funzionare correttamente a temperature “permissive” ma perde la sua funzione nativa a temperature “non permissive”. Questo rende possibile studiare il fenotipo knockout (alla temperatura non permissiva) pur avendo la comodità di poter propagare facilmente gli organismi (alla temperatura permissiva). L’intero genoma di S. cerevisiae è disponibile in librerie di plasmidi, rendendo possibile lo screening di quale plasmide salva il fenotipo di un dato mutante. È così che sono stati scoperti molti dei geni che regolano il ciclo cellulare.
In S. cerivisiae, la gemmazione fa parte della fase G1, e una volta che la cellula figlia raggiunge una certa dimensione, in un momento chiamato “START”, i due sono impegnati ad entrare in S e infine a completare il ciclo cellulare. Le cellule dei mammiferi hanno il loro punto di impegno chiamato punto di restrizione o R, in G1, che è analogo a START.
I mutanti Cdc28 sensibili alla temperatura non germogliano alla temperatura non permissiva. Il gene Cdc28 codifica l’omologo del lievito della nostra chinasi dipendente dalla ciclina (CDK) che, quando e solo quando complessata con la ciclina, può fosforilare altre proteine per regolare la loro partecipazione alle fasi del ciclo cellulare. I mutanti termosensibili alla temperatura non permissiva si bloccano incapaci di germogliare ed entrare nella fase S. Invece, si comportano come le cellule wild-type private di nutrienti: crescono abbastanza per passare lo START ma poi non continuano.
Xenopus (una specie di rana) si è rivelato fondamentale per la comprensione del ciclo cellulare, perché la sua riproduzione coinvolge un numero molto grande di cellule (cioè abbastanza materiale di partenza per i Western blot, ecc) che sono perfettamente sincronizzate (cioè tutte sono nella stessa fase del ciclo cellulare nello stesso momento. (Confronta con il lievito, per esempio, dove le cellule non saranno tutte nella stessa fase nello stesso momento). Anche l’uovo stesso è grande e facile da lavorare, e più cicli cellulari seguono la fecondazione. Nelle rane, le uova iniziano la divisione meiotica ma poi si arrestano alla fase G2 per 8 mesi mentre crescono di dimensioni e accumulano cose che saranno necessarie per la crescita al momento della fecondazione.
Filamenti intermedi
In aggiunta ai microfilamenti e ai microtubuli, le cellule eucariotiche hanno anche una serie di ‘altre’ proteine citoscheletriche chiamate filamenti intermedi (IF). Anche se più diversi dei microfilamenti e dei microtubuli, gli IF non sono solo un termine generico per “qualsiasi altro filamento” – piuttosto, sono un gruppo di proteine correlate. Generalmente si estendono attraverso il citoplasma e l’involucro nucleare interno, non sono polari e non hanno proteine motorie associate a loro. Hanno una grande resistenza alla trazione e sono molto stabili, con un lento tasso di scambio e non molta disgregazione, anche se la fosforilazione può promuovere il loro smontaggio. Ecco alcuni esempi popolari:
- Le cheratine si trovano nelle cellule epiteliali, nelle cellule del mesoderma e nei neuroni. Forniscono forza e sono disponibili in forme acide e basiche. Ciascuna può formare un proprio filamento, ma la maggior parte degli IF consiste in due filamenti – uno basico e uno acido, una specie di attorcigliamento l’uno intorno all’altro. I capelli e le unghie sono fatti di cheratina “dura” ricca di cisteina per i legami disolfuro che fornisce l’immensa forza. Le permanenti e la stiratura si basano sulla riduzione dei legami disolfuro, rimodellando i capelli e poi riformando i legami disolfuro. Abbiamo anche una cheratina “morbida” nella nostra pelle.
- Le desmine come la vimentina si trovano nelle cellule mesenchimali (ossa, cartilagini e grasso).
- I neurofilamenti si trovano negli assoni neuronali e ne regolano il diametro, che a sua volta determina la velocità di propagazione del potenziale d’azione.
- Le lamine sono le più diffuse e si ritiene siano le più simili all’antenato filogenetico di tutti gli altri FI. Forniscono supporto strutturale alla membrana nucleare. Potrebbero aiutare a distanziare i complessi dei pori nucleari e anche a organizzare il DNA.
Infine, un video riassuntivo: