Creative Proteomics Blog
Western blot è stato introdotto da Towbin et al. nel 1979, che è un metodo comunemente usato per l’analisi delle proteine. Può essere usato per l’analisi qualitativa e semi-quantitativa delle proteine. Per la realizzazione del western blot, ci sono tre elementi, la separazione delle proteine per dimensione, il trasferimento delle proteine su un supporto solido, e la marcatura delle proteine con anticorpi primari e secondari per la visualizzazione.
Il principio del Western Blot
Western blot viene eseguito utilizzando l’elettroforesi su gel di polipropilene. La SDS-PAGE permette ai campioni di proteine di essere separati e trasferiti su un supporto solido, come la nitrocellulosa (NC) o la membrana di polivinilidene difluoruro (PVDF). Il supporto solido può assorbire la proteina e mantenere inalterata la sua attività biologica. La membrana di supporto solido trasferita è chiamata blot e viene trattata con una soluzione proteica per bloccare il sito di legame idrofobico sulla membrana. La membrana viene trattata con l’anticorpo (anticorpo primario) delle proteine bersaglio. Solo le proteine da studiare possono legarsi specificamente all’anticorpo primario per formare un complesso antigene-anticorpo. Dopo che l’anticorpo primario viene lavato e rimosso, solo la posizione della proteina bersaglio si lega all’anticorpo primario. Le membrane trattate con l’anticorpo primario sono trattate con un anticorpo secondario marcato dopo il lavaggio. Dopo il trattamento, l’anticorpo secondario etichettato che si lega all’anticorpo primario forma un complesso anticorpale che può indicare la posizione dell’anticorpo primario, sia la posizione della proteina studiata.
La procedura del Western Blot
Ci sono sei fasi coinvolte nel western blot, compresa la preparazione del campione, l’elettroforesi del gel, il trasferimento delle proteine, il bloccaggio, l’incubazione dell’anticorpo e la rilevazione e visualizzazione delle proteine.
1. Preparazione del campione.
Le proteine possono essere estratte da diversi campioni, come tessuti o cellule. Poiché i campioni di tessuto mostrano un più alto grado di struttura, i tessuti vengono prima scomposti dall’invenzione meccanica, come l’omogeneizzatore o la sonicazione. Gli inibitori di proteasi e fosfatasi sono comunemente usati per prevenire la digestione del campione a basse temperature. Dopo l’estrazione delle proteine, è importante rilevare la concentrazione delle proteine, il che permette la massa di proteine caricate in ogni pozzetto. E uno spettrofotometro è spesso usato per la concentrazione delle proteine.
2. Elettroforesi su gel.

Il gel più comunemente usato è il gel di poliacrilammide (PAG) e tamponi caricati con sodio dodecil solfato (SDS). Il Western blot utilizza due tipi di gel di agarosio: il gel impilante che è utilizzato per concentrare tutte le proteine in un’unica banda e il gel separatore che permette di separare le proteine in base al loro peso molecolare. Le proteine più piccole migrano più velocemente nella SDS-PAGE quando viene applicata una tensione. La PAGE può separare proteine che vanno da 5 a 2.000 kDa secondo la dimensione uniforme dei pori che è controllata dalla diversa concentrazione di PAG. Tipicamente i gel di separazione sono fatti al 5%, 8%, 10%, 12% o 15%. Quando scegliamo la percentuale appropriata del gel separatore, dobbiamo considerare la dimensione delle proteine target. Più piccolo è il peso noto delle proteine, più alta è la percentuale di gel da utilizzare.
3. Trasferimento delle proteine.
Dopo aver separato le proteine con l’elettroforesi su gel, le proteine vengono spostate dall’interno del gel su una membrana di supporto solido per rendere le proteine accessibili al rilevamento degli anticorpi. Il metodo principale per trasferire le proteine è chiamato elettroblottatura, che utilizza un campo elettrico orientato perpendicolarmente alla superficie del gel, per tirare le proteine fuori dal gel e spostarle nella membrana. Può essere fatto in condizioni semi-asciutte o bagnate, mentre le condizioni bagnate sono di solito più affidabili in quanto è meno probabile che il gel si secchi. Come mostrato nella figura a sinistra, la membrana è posta tra la superficie del gel e il filtro. Il sandwich di trasferimento viene creato come segue: un tampone in fibra (spugna), carte da filtro, il gel, una membrana, carte da filtro, un tampone in fibra (spugna).
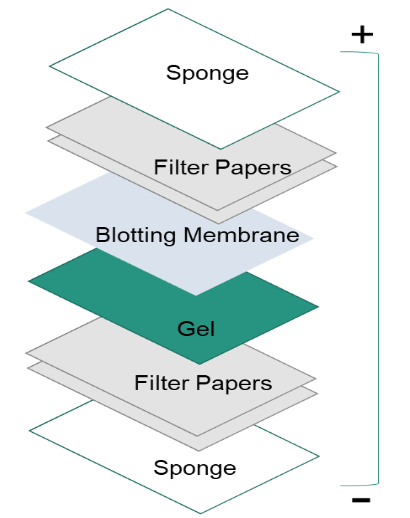 4. Blocco.
4. Blocco.
Il blocco è un passo importante nel western blot per impedire agli anticorpi di legarsi alla membrana in modo non specifico. I bloccanti tipici più comunemente usati sono BSA e latte secco non grasso. Quando la membrana viene posta nella soluzione diluita di proteine, le proteine si attaccano a tutti i punti della membrana dove le proteine target non si sono attaccate. In questo modo, il “rumore” nel prodotto finale del western blot può essere ridotto e portare a risultati più chiari.
5. Incubazione dell’anticorpo.
Dopo il blocco, l’anticorpo primario si lega alla proteina bersaglio quando l’anticorpo primario viene incubato con la membrana. La scelta di un anticorpo primario dipende dall’antigene da rilevare. Il lavaggio della membrana con la soluzione antibody-buffer è utile per minimizzare lo sfondo e rimuove gli anticorpi non legati. Dopo il risciacquo, la membrana viene esposta all’anticorpo secondario coniugato con un enzima specifico. Quando si esegue l’incubazione dell’anticorpo secondario, l’anticorpo secondario marcato può legarsi all’anticorpo primario che ha reagito con le proteine target. In base alla specie dell’anticorpo primario, possiamo scegliere l’anticorpo secondario appropriato.
6. Rilevamento e visualizzazione delle proteine.
Un substrato reagisce con l’enzima che è legato all’anticorpo secondario per generare una sostanza colorata. Ci permette di conoscere la densitometria e la posizione della proteina bersaglio. E le approssimazioni delle dimensioni sono prese confrontando le bande di proteine con il marcatore. Ci sono diversi sistemi di rilevamento disponibili per la visualizzazione delle proteine, come il rilevamento colorimetrico, il rilevamento chemiluminescente, il rilevamento radioattivo e il rilevamento fluorescente. Il sistema di elettrochemiluminescenza (ECL) è il metodo di rilevamento più comune.
Il western blot è comunemente usato per il rilevamento qualitativo delle proteine e delle modifiche post-traslazionali (ad esempio la fosforilazione). Inoltre, può anche essere usato nella diagnostica medica, come il test HIV o il test BSE.