Fatti sull’elemento azoto
L’elemento chimico azoto è classificato come un gas e un non metallo. Fu scoperto nel 1772 da Daniel Rutherford e indipendentemente da Carl Scheele.

Data Zone
| Classificazione: | L’azoto è un gas e un non metallo |
| Colore: | incolore |
| Peso atomico: | 14.0067 |
| Stato: | gas |
| Punto di fusione: | -210.1 oC, 63.05 K |
| Punto di ebollizione: | -195.8 oC, 77.4 K |
| Elettroni: | 7 |
| Protoni: | 7 |
| Neutroni in isotopo più abbondante: | 7 |
| Gusci di elettroni: | 2,5 |
| Configurazione degli elettroni: | 1s2 2s2 2p3 |
| Densità @ 20oC: | 0.0012506 g/cm3 |
Mostra altro, incluso: Calori, Energie, Ossidazione,
Reazioni, Composti, Raggi, Conducibilità
| Volume atomico: | 17.3 cm3/mol |
| Struttura: | hcp: esagonale impaccato |
| Capacità termica specifica | 1.04 J g-1 K-1 |
| Calore di fusione | 0,720 kJ mol-1 di N2 |
| Calore di atomizzazione | 473 kJ mol-1 |
| Calore di vaporizzazione | 5.57 kJ mol-1 di N2 |
| 1a energia di ionizzazione | 1402.3 kJ mol-1 |
| 2a energia di ionizzazione | 2856 kJ mol-1 |
| 3a energia di ionizzazione | 4578 kJ mol-1 |
| affinità degli elettroni | -6.75 kJ mol-1 |
| Numero minimo di ossidazione | -3 |
| Numero minimo di ossidazione comune. | -3 |
| Massimo numero di ossidazione | 5 |
| Massimo numero di ossidazione comune. | 5 |
| Elettronegatività (Scala Pauling) | 3.04 |
| Volume di polarizzabilità | 1.1 Å3 |
| Reazione con aria | nessuno |
| Reazione con 15 M HNO3 | nessuno |
| Reazione con 6 M HCl | nessuno |
| Reazione con 6 M NaOH | nessuno |
| Ossido(i) | N2O, NO, NO2, N2O5 |
| Idruro(i) | NH3 (ammoniaca), N2H4 (idrazina), HN3 (acido idrazoico) |
| Cloruro(s) | NCl3 |
| Raggio atomico | 65 pm |
| Raggio ionico (ione 1+) | – |
| Raggio ionico (2+ ione) | – |
| Raggio ionico (3+ ione) | 30 pm |
| Raggio ionico (1- ione) | – |
| Raggio ionico (2- ione) | – |
| Raggio ionico (3-ione) | – |
| Conducibilità termica | 0.02583 W m-1 K-1 |
| Conducibilità elettrica | – |
| Punto di congelamento/fusione: | -210.1 oC, 63.05 K |
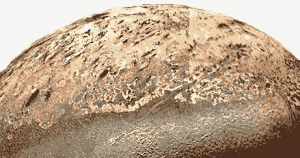
Immagine Nasa. I geyser di azoto di Tritone spingono particelle nere a chilometri dalla superficie. Queste vengono soffiate dai venti su Tritone e formano depositi neri sulla superficie del satellite. (Vedi Fatti, sotto.)

L’azoto liquido condensa vapore acqueo dall’aria circostante. NASA.
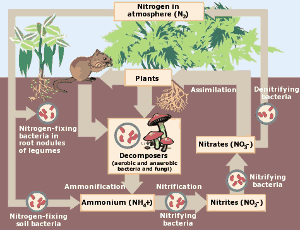
Il ciclo dell’azoto. Clicca qui per ingrandire l’immagine. (Per gentile concessione dell’Environmental Protection Agency)
La scoperta dell’azoto
Nel 1674 il medico inglese John Mayow dimostrò che l’aria non è un unico elemento, ma è composta da diverse sostanze. Lo fece dimostrando che solo una parte dell’aria è combustibile. La maggior parte non lo è. (1)
Quasi un secolo dopo, il chimico scozzese Joseph Black realizzò un lavoro più dettagliato sull’aria. Dopo aver rimosso l’ossigeno e l’anidride carbonica, una parte dell’aria rimaneva.
Black usò il fosforo bruciato come ultimo passo per la rimozione dell’ossigeno. (Il fosforo che brucia ha un’affinità molto alta per l’ossigeno ed è efficiente nel rimuoverlo completamente). Black ha poi assegnato ulteriori studi sui gas nell’aria al suo studente di dottorato, Daniel Rutherford. (2)
Rutherford costruì sul lavoro di Black e in una serie di passi rimosse completamente l’ossigeno e l’anidride carbonica dall’aria. Mostrò che, come l’anidride carbonica, il gas residuo non poteva sostenere la combustione o gli organismi viventi. A differenza dell’anidride carbonica, però, l’azoto era insolubile in acqua e in soluzioni alcaline. Rutherford riportò la sua scoperta nel 1772 dell'”aria nociva”, che oggi chiamiamo azoto. (3)
Il farmacista svedese Carl Scheele scoprì l’azoto in modo indipendente, chiamandolo aria esausta.
Scheele assorbì l’ossigeno in vari modi, tra cui usando una miscela di zolfo e limatura di ferro e bruciando fosforo. Dopo aver rimosso l’ossigeno, riportò un gas residuo che non avrebbe sostenuto la combustione e aveva tra i due terzi e i tre quarti del volume dell’aria originale. Scheele pubblicò i suoi risultati nel 1777, anche se si pensa che il lavoro sia stato svolto nel 1772. (4)
Anche se Rutherford e Scheele sono ora accreditati congiuntamente con la scoperta dell’azoto, sembra che sia stato scoperto prima da Henry Cavendish, ma non pubblicato.
Prima del 1772 (la data precisa è sconosciuta – Priestley vi fa riferimento nella sua opera “Experiments and Observations Made in and Before the Year 1772”) Cavendish scrisse a Joseph Priestley descrivendo “aria bruciata”.
L'”aria bruciata” era stata preparata facendo passare ripetutamente l’aria su carbone rosso caldo (rimuovendo l’ossigeno) e poi facendo gorgogliare il gas rimanente attraverso una soluzione di potassa caustica (idrossido di potassio) che avrebbe rimosso l’anidride carbonica.
Cavendish scrisse: “Il peso specifico di quest’aria è stato trovato molto diverso da quello dell’aria comune; dei due, sembrava piuttosto più leggero. Spegneva la fiamma e rendeva l’aria comune inadatta a far bruciare i corpi allo stesso modo dell’aria fissa, ma in misura minore, poiché una candela che bruciava circa 80″ in aria comune pura, e che si spegneva immediatamente in aria comune mescolata con 6/55 di aria fissa, bruciava circa 26″ in aria comune mescolata con la stessa porzione di questa aria bruciata.” (5)
Nel 1790 il chimico francese Jean-Antoine-Claude Chaptal nominò l’elemento ‘azoto’ dopo che gli esperimenti dimostrarono che era un costituente del nitro, come veniva chiamato allora il nitrato di potassio.
Fatti interessanti sull’azoto
- Circa il 2,5% del peso degli organismi viventi deriva dall’azoto nelle molecole organiche.
- Molte delle molecole della vita contengono azoto. È il quarto elemento più abbondante nel corpo umano.
- Il composto azotato nitroglicerina può essere usato per alleviare l’angina, una condizione cardiaca pericolosa per la vita.
- Il satellite di Nettuno, Tritone, ha cinque miglia di altezza, geyser alimentati da azoto.
Come la Terra, l’atmosfera di Tritone è principalmente azoto, ma Tritone è così freddo che l’azoto si trova sulla superficie come un solido di roccia. L’azoto solido permette alla debole luce che arriva dal sole di attraversarlo. Le impurità scure nel ghiaccio di azoto o nelle rocce più scure sotto il ghiaccio si riscaldano leggermente alla luce del sole, sciogliendo e vaporizzando l’azoto solido, che alla fine si rompe attraverso l’azoto solido come geyser che spingono le particelle di ghiaccio da una a cinque miglia sopra la superficie ghiacciata di Tritone. - L’azoto è il settimo elemento più abbondante nell’universo.
- Nel 1919, il mondo apprese per la prima volta che i nuclei atomici potevano essere disintegrati. Ernest Rutherford riferì di aver bombardato l’azoto gassoso con particelle alfa (nuclei di elio) e scoprì che veniva prodotto idrogeno. (Ulteriori ricerche di Patrick Blackett mostrarono che le particelle alfa avevano trasmutato l’azoto-14 in ossigeno-17 più idrogeno.)
- L’azoto dell’universo è stato fatto, e viene fatto, dal ciclo CNO nelle stelle più pesanti del nostro sole. (Vedi l’immagine qui sotto)
L’azoto e il ciclo CNO
Quando la prima generazione di stelle dell’universo è nata, conteneva solo gli elementi prodotti nel big bang: idrogeno, elio e una piccola quantità di litio.
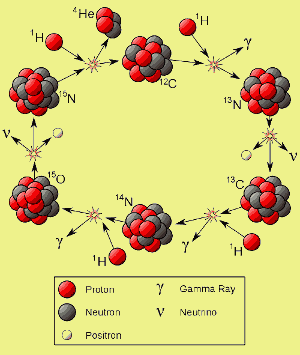
Clicca qui per ingrandire. Immagine di Borb.
Quando queste stelle bruciavano, sintetizzavano elementi più pesanti, come il carbonio. Le supernove hanno poi diffuso gli elementi più pesanti nelle galassie dove sono nate altre stelle.
Il carbonio proveniente dalle supernove gioca un ruolo cruciale nel modo in cui bruciano molte stelle di seconda e più alta generazione. Nelle stelle la cui massa è superiore a circa 1,1 – 1,5 volte quella del nostro sole, il carbonio-12 catalizza la fusione dell’idrogeno in elio – cioè il carbonio-12 partecipa alla reazione di fusione, ma non viene consumato da essa.
Come potete vedere sulla sinistra, il carbonio-12 viene rigenerato alla fine di ogni ciclo, il cui risultato netto è che quattro nuclei di idrogeno vengono consumati e un nucleo di elio viene prodotto. Questa reazione è chiamata ciclo CNO.
Nel tempo, ogni nucleo di carbonio-12 può prendere parte ad un numero molto grande di cicli. Una parte dell’azoto prodotto durante il ciclo CNO sfugge a ulteriori reazioni. Alla fine della vita di una stella, questo azoto può essere distribuito nella galassia. Nel nostro sistema solare l’azoto di una stella morta miliardi di anni fa è finito come elemento essenziale nelle proteine e nel DNA e ha formato circa l’80% dell’atmosfera del nostro pianeta.

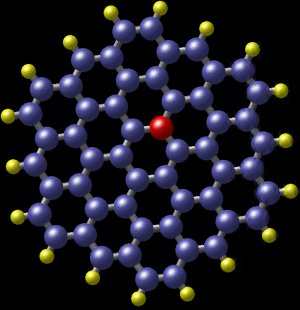
Un idrocarburo policiclico aromatico con azoto. Le palline blu sono atomi di carbonio e le palline gialle sono atomi di idrogeno. La pallina rossa mostra la posizione di un atomo di azoto che si adatta quasi perfettamente alla molecola. Questa molecola è stata rilevata nella galassia a spirale M81, a circa 12 milioni di anni luce dalla Terra. (Immagine: Nasa)
Aspetto e caratteristiche
Effetti nocivi:
L’azoto non è tossico in condizioni normali.
Il contatto diretto della pelle con l’azoto liquido causa gravi congelamenti.
La decompressione in subacquei o astronauti può causare la ‘curva’ – una condizione potenzialmente fatale quando si formano bolle di azoto nel flusso sanguigno.
Caratteristiche:
L’azoto è un gas incolore, inodore, insapore, biatomico e generalmente inerte a temperatura e pressione standard.
A pressione atmosferica, l’azoto è liquido tra 63 K e 77 K.
I liquidi più freddi di questo sono considerevolmente più costosi da produrre dell’azoto liquido.
Usi dell’azoto
L’azoto è usato per produrre ammoniaca (processo Haber) e fertilizzanti, vitali per gli attuali metodi di produzione alimentare. È anche usato per produrre acido nitrico (processo Ostwald).
Nel recupero migliorato del petrolio, l’azoto ad alta pressione è usato per forzare il petrolio greggio che altrimenti non sarebbe recuperato dai pozzi di petrolio. Le qualità inerti dell’azoto sono usate nell’industria chimica e petrolifera per ricoprire i serbatoi di stoccaggio con uno strato inerte di gas.
L’azoto liquido è usato come refrigerante. I superconduttori per le tecnologie pratiche dovrebbero idealmente non avere resistenza elettrica a temperature superiori a 63 K, perché questa temperatura è raggiungibile in modo relativamente economico usando l’azoto liquido. Temperature più basse hanno un prezzo molto più alto.
Mentre l’azoto elementare non è molto reattivo, molti dei composti dell’azoto sono instabili.
Gli ossidi si formano naturalmente nell’acciaio durante la saldatura e questi indeboliscono la saldatura. L’azoto può essere usato per escludere l’ossigeno durante la saldatura, ottenendo saldature migliori.
Nel mondo naturale, il ciclo dell’azoto è di importanza cruciale per gli organismi viventi. L’azoto viene preso dall’atmosfera e convertito in nitrati attraverso le tempeste di fulmini e i batteri fissatori dell’azoto. I nitrati fertilizzano la crescita delle piante dove l’azoto si lega agli aminoacidi, al DNA e alle proteine. Può poi essere mangiato dagli animali. Alla fine l’azoto delle piante e degli animali ritorna al suolo e all’atmosfera e il ciclo si ripete.
Abbondanza e isotopi
Abbondanza crosta terrestre: 19 parti per milione in peso, 28 parti per milione in mole
Abbondanza sistema solare: 1.000 ppm in peso, 90 ppm in mole
Costo, puro: $0.4 per 100g
Costo, sfuso: $ per 100g
Fonte: Commercialmente, l’azoto è ottenuto dall’aria liquida per distillazione frazionata. L’atmosfera terrestre contiene circa 4 quadrilioni di tonnellate (4 x 1015) di azoto.
Isotopi: L’azoto ha 12 isotopi la cui emivita è nota, con numeri di massa da 11 a 19. L’azoto naturale è una miscela di due isotopi, 14N e 15N con abbondanze naturali del 99,6% e 0,4% rispettivamente.

- Alexander Findlay, Chemistry in the Service of Man., (2007) p46. Findlay Press.
- Aaron John Ihde, The Development of Modern Chemistry., (2007) p38. Dover Publications.
- Jonathan Shectman, Groundbreaking Scientific Experiments, Inventions, and Discoveries of the 18th Century., (2003) p78. Greenwood Publishing Group.
- Ida Freund, The Experimental Basis Of Chemistry – Suggerimenti per una serie di esperimenti illustrativi dei principi fondamentali della chimica, (2007) p145. Caffin Press.
- George Wilson, The Life of Henry Cavendish., (1851) p28. La società Cavendish. (pdf – download grande 31 MB).
- Royston M. Roberts, Serendipity, Accidental Discoveries in Science., (1989) p89. John Wiley and Sons.
Citare questa pagina
Per il collegamento online, si prega di copiare e incollare uno dei seguenti:
<a href="https://www.chemicool.com/elements/nitrogen.html">Nitrogen</a>
o
<a href="https://www.chemicool.com/elements/nitrogen.html">Nitrogen Element Facts</a>
Per citare questa pagina in un documento accademico, usa la seguente citazione conforme agli standard MLA:
"Nitrogen." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/nitrogen.html>.