Il premio Nobel Il logo del premio Nobel
Inglese
Inglese (pdf)
Svedese
![]()
L’Assemblea Nobel del Karolinska Institutet ha deciso oggi di assegnare
il Premio Nobel 2016 per la Fisiologia o la Medicina
a
Yoshinori Ohsumi
per le sue scoperte sui meccanismi dell’autofagia
Sommario
Il Premio Nobel di quest’anno ha scoperto e chiarito i meccanismi alla base dell’autofagia, un processo fondamentale per degradare e riciclare i componenti cellulari.
La parola autofagia ha origine dalle parole greche auto-, che significa “sé”, e phagein, che significa “mangiare”. Così, l’autofagia denota “mangiare se stessi”. Questo concetto emerse negli anni ’60, quando i ricercatori osservarono per la prima volta che la cellula poteva distruggere il proprio contenuto racchiudendolo in membrane, formando vescicole a forma di sacco che venivano trasportate in un compartimento di riciclaggio, chiamato lisosoma, per essere degradate. Le difficoltà nello studio del fenomeno hanno fatto sì che si sapesse poco fino a quando, in una serie di brillanti esperimenti nei primi anni ’90, Yoshinori Ohsumi ha utilizzato il lievito di birra per identificare i geni essenziali per l’autofagia. Ha poi continuato a chiarire i meccanismi alla base dell’autofagia nel lievito e ha dimostrato che un meccanismo sofisticato simile è utilizzato nelle nostre cellule.
Le scoperte di Ohsumi hanno portato a un nuovo paradigma nella nostra comprensione di come la cellula ricicla il suo contenuto. Le sue scoperte hanno aperto la strada alla comprensione dell’importanza fondamentale dell’autofagia in molti processi fisiologici, come l’adattamento alla fame o la risposta alle infezioni. Le mutazioni nei geni dell’autofagia possono causare malattie, e il processo autofagico è coinvolto in diverse condizioni tra cui il cancro e le malattie neurologiche.
Degradazione – una funzione centrale in tutte le cellule viventi
A metà degli anni ’50 gli scienziati osservarono un nuovo compartimento cellulare specializzato, chiamato organello, contenente enzimi che digeriscono proteine, carboidrati e lipidi. Questo compartimento specializzato è chiamato “lisosoma” e funziona come una stazione di lavoro per la degradazione dei costituenti cellulari. Lo scienziato belga Christian de Duve ha ricevuto il premio Nobel in fisiologia o medicina nel 1974 per la scoperta del lisosoma. Nuove osservazioni durante gli anni ’60 mostrarono che grandi quantità di contenuto cellulare, e persino interi organelli, potevano talvolta trovarsi all’interno dei lisosomi. La cellula sembrava quindi avere una strategia per consegnare grandi carichi al lisosoma. Ulteriori analisi biochimiche e microscopiche hanno rivelato un nuovo tipo di vescicola che trasporta il carico cellulare al lisosoma per la degradazione (Figura 1). Christian de Duve, lo scienziato dietro la scoperta del lisosoma, ha coniato il termine autofagia, “autoalimentazione”, per descrivere questo processo. Le nuove vescicole sono state chiamate autofagosomi.
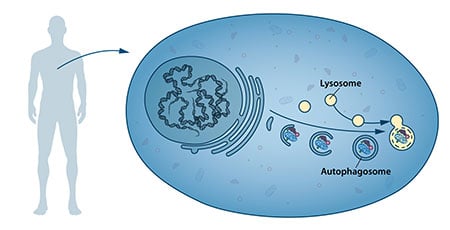
Durante gli anni ’70 e ’80 i ricercatori si sono concentrati sul chiarimento di un altro sistema utilizzato per degradare le proteine, ovvero il “proteasoma”. In questo campo di ricerca, Aaron Ciechanover, Avram Hershko e Irwin Rose hanno ricevuto il premio Nobel per la chimica nel 2004 per “la scoperta della degradazione delle proteine mediata dall’ubiquitina”. Il proteasoma degrada efficacemente le proteine una per una, ma questo meccanismo non spiegava come la cellula si liberasse di complessi proteici più grandi e di organelli usurati. Il processo di autofagia potrebbe essere la risposta e, in caso affermativo, quali sono i meccanismi?
Un esperimento rivoluzionario
Yoshinori Ohsumi era stato attivo in varie aree di ricerca, ma quando ha iniziato il suo laboratorio nel 1988, ha concentrato i suoi sforzi sulla degradazione delle proteine nel vacuolo, un organello che corrisponde al lisosoma nelle cellule umane. Le cellule di lievito sono relativamente facili da studiare e di conseguenza sono spesso usate come modello per le cellule umane. Sono particolarmente utili per l’identificazione di geni che sono importanti in percorsi cellulari complessi. Ma Ohsumi ha affrontato una grande sfida: le cellule di lievito sono piccole e le loro strutture interne non sono facilmente distinguibili al microscopio e quindi non era sicuro che l’autofagia esistesse anche in questo organismo. Ohsumi pensò che se avesse potuto interrompere il processo di degradazione nel vacuolo mentre il processo di autofagia era attivo, allora gli autofagosomi avrebbero dovuto accumularsi nel vacuolo e diventare visibili al microscopio. Ha quindi coltivato lieviti mutati privi di enzimi di degradazione vacuolare e contemporaneamente ha stimolato l’autofagia facendo morire di fame le cellule. I risultati sono stati sorprendenti! In poche ore, i vacuoli erano pieni di piccole vescicole che non erano state degradate (Figura 2). Le vescicole erano autofagosomi e l’esperimento di Ohsumi ha dimostrato che l’autofagia esiste nelle cellule di lievito. Ma ancora più importante, ora aveva un metodo per identificare e caratterizzare i geni chiave coinvolti in questo processo. Questo fu un importante passo avanti e Ohsumi pubblicò i risultati nel 1992.

Sono stati scoperti i geni dell’autofagia
Ohsumi ora ha approfittato dei suoi ceppi di lievito ingegnerizzati in cui gli autofagosomi si accumulavano durante la fame. Questo accumulo non dovrebbe verificarsi se i geni importanti per l’autofagia fossero inattivati. Ohsumi ha esposto le cellule di lievito a una sostanza chimica che ha introdotto casualmente mutazioni in molti geni, e poi ha indotto l’autofagia. La sua strategia ha funzionato! Entro un anno dalla sua scoperta dell’autofagia nel lievito, Ohsumi aveva identificato i primi geni essenziali per l’autofagia. Nella sua successiva serie di eleganti studi, le proteine codificate da questi geni sono state caratterizzate funzionalmente. I risultati hanno mostrato che l’autofagia è controllata da una cascata di proteine e complessi proteici, ognuno dei quali regola una fase distinta dell’inizio e della formazione dell’autofagosoma (Figura 3).
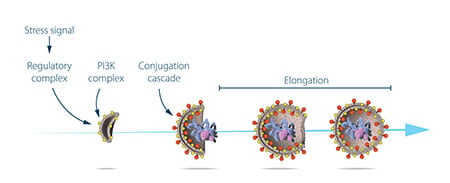
Autofagia – un meccanismo essenziale nelle nostre cellule
Dopo l’identificazione del meccanismo di autofagia nel lievito, rimaneva una domanda chiave. Esisteva un meccanismo corrispondente per controllare questo processo in altri organismi? Ben presto divenne chiaro che meccanismi virtualmente identici operano nelle nostre cellule. Gli strumenti di ricerca necessari per studiare l’importanza dell’autofagia negli esseri umani erano ora disponibili.
Grazie a Ohsumi e ad altri che hanno seguito le sue orme, ora sappiamo che l’autofagia controlla importanti funzioni fisiologiche in cui i componenti cellulari devono essere degradati e riciclati. L’autofagia può fornire rapidamente il carburante per l’energia e i mattoni per il rinnovo dei componenti cellulari, ed è quindi essenziale per la risposta cellulare alla fame e ad altri tipi di stress. Dopo un’infezione, l’autofagia può eliminare i batteri e i virus intracellulari invasori. L’autofagia contribuisce allo sviluppo embrionale e alla differenziazione cellulare. Le cellule usano anche l’autofagia per eliminare le proteine e gli organelli danneggiati, un meccanismo di controllo della qualità che è fondamentale per contrastare le conseguenze negative dell’invecchiamento.
L’autofagia interrotta è stata collegata al morbo di Parkinson, al diabete di tipo 2 e ad altri disturbi che compaiono negli anziani. Mutazioni nei geni dell’autofagia possono causare malattie genetiche. Disturbi nel macchinario autofagico sono stati anche collegati al cancro. Sono in corso intense ricerche per sviluppare farmaci che possano avere come bersaglio l’autofagia in varie malattie.
L’autofagia è nota da oltre 50 anni, ma la sua importanza fondamentale nella fisiologia e nella medicina è stata riconosciuta solo dopo la ricerca di Yoshinori Ohsumi che ha cambiato il paradigma negli anni ’90. Per le sue scoperte, quest’anno gli è stato assegnato il premio Nobel per la fisiologia o la medicina.
Pubblicazioni chiave
Takeshige, K., Baba, M., Tsuboi, S., Noda, T. e Ohsumi, Y. (1992). L’autofagia nel lievito dimostrata con mutanti carenti di proteinasi e condizioni per la sua induzione. Journal of Cell Biology 119, 301-311
Tsukada, M. and Ohsumi, Y. (1993). Isolamento e caratterizzazione di mutanti con difetto di autofagia di Saccharomyces cervisiae. FEBS Letters 333, 169-174
Mizushima, N., Noda, T., Yoshimori, T., Tanaka, Y., Ishii, T., George, M.D., Klionsky, D.J., Ohsumi, M. and Ohsumi, Y. (1998). Un sistema di coniugazione delle proteine essenziale per l’autofagia. Nature 395, 395-398
Ichimura, Y., Kirisako T., Takao, T., Satomi, Y., Shimonishi, Y., Ishihara, N., Mizushima, N., Tanida, I., Kominami, E., Ohsumi, M., Noda, T. e Ohsumi, Y. (2000). Un sistema simile all’ubiquitina media la lipidazione delle proteine. Nature, 408, 488-492
Yoshinori Ohsumi è nato nel 1945 a Fukuoka, Giappone. Ha ricevuto un dottorato all’Università di Tokyo nel 1974. Dopo aver trascorso tre anni alla Rockefeller University, New York, USA, è tornato all’Università di Tokyo dove ha fondato il suo gruppo di ricerca nel 1988. Dal 2009 è professore al Tokyo Institute of Technology.
L’Assemblea del Nobel, composta da 50 professori del Karolinska Institutet, assegna il premio Nobel in fisiologia o medicina. Il suo Comitato Nobel valuta le candidature. Dal 1901 il Premio Nobel viene assegnato agli scienziati che hanno fatto le scoperte più importanti per il beneficio dell’umanità.
Il Premio Nobel® è il marchio registrato della Fondazione Nobel