Introduzione al legame chimico
Diagrammi di Lewis per composti molecolari/ioni
Per disegnare i diagrammi di Lewis per composti molecolari o ioni, segui i seguenti passi (useremo H2O come esempio da seguire):
1) Conta il numero di elettroni di valenza del composto molecolare o ione. Ricorda, se ci sono due o più dello stesso elemento, allora devi raddoppiare o moltiplicare per quanti atomi ci sono il numero di elettroni di valenza. Segui il numero del gruppo di numeri romani per vedere il numero corrispondente di elettroni di valenza che ci sono per quell’elemento.
Elettroni di valenza:
Ossigeno (O)–Gruppo VIA: quindi, ci sono 6 elettroni di valenza
Idrogeno (H)–Gruppo IA: quindi, c’è 1 elettrone di valenza
NOTA: Ci sono DUE atomi di idrogeno, quindi moltiplicare 1 elettrone di valenza X 2 atomi
Totale: 6 + 2 = 8 elettroni di valenza
2) Se la molecola in questione è uno ione, ricorda di aggiungere o sottrarre il rispettivo numero di elettroni al totale del passo 1.
Per gli ioni, se lo ione ha una carica negativa (anione), aggiungi il numero di elettroni corrispondente al numero totale di elettroni (cioè se NO3- ha una carica negativa di 1-, allora aggiungi 1 elettrone in più al totale; 5 + 3(6)= 23 +1 = 24 elettroni totali). Un segno – significa che la molecola ha una carica negativa complessiva, quindi deve avere questo elettrone extra. Questo perché gli anioni hanno una maggiore affinità elettronica (tendenza a guadagnare elettroni). La maggior parte degli anioni sono composti da non metalli, che hanno un’alta elettronegatività.
Se lo ione ha una carica positiva (catione), sottrai il numero corrispondente di elettroni al numero totale di elettroni (cioè H3O+ ha una carica positiva di 1+, quindi sottrai 1 elettrone extra al totale; 6 + 1(3) = 9 – 1 = 8 elettroni totali). Un segno + significa che la molecola ha una carica positiva complessiva, quindi deve mancare un elettrone. I cationi sono positivi e hanno un’affinità di elettroni più debole. Sono composti principalmente da metalli; i loro raggi atomici sono più grandi dei non metalli. Questo significa di conseguenza che la schermatura è maggiore, e gli elettroni hanno meno tendenza ad essere attratti dal nucleo “schermato”.
Dal nostro esempio, l’acqua è una molecola neutra, quindi non è necessario aggiungere o sottrarre elettroni dal totale.
3) Scrivi i simboli degli elementi, assicurandoti che tutti gli atomi siano presenti (es. H2O, scrivi O e 2 H su entrambi i lati dell’ossigeno). Inizia ad aggiungere legami singoli (1 coppia di elettroni) a tutti i possibili atomi assicurandoti che seguano la regola dell’ottetto (con le eccezioni della regola del duetto e degli altri elementi menzionati sopra).
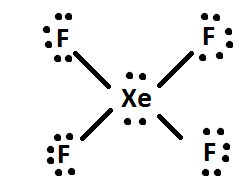
4) Se ci sono degli elettroni rimasti, aggiungili all’atomo centrale della molecola (es. XeF4 ha 4 elettroni extra dopo essere stato distribuito, quindi i 4 elettroni extra vengono dati a Xe: così. Infine, riorganizzare le coppie di elettroni in doppi o tripli legami, se possibile.