JOP. Journal of the Pancreas
Keywords
Chetoacidosi diabetica; Iperlipidemie; Ipertrigliceridemia
INTRODUZIONE
La chetoacidosi diabetica è una complicanza acuta e pericolosa per la vita del diabete mellito. Fino al 30% dei pazienti, con diabete appena diagnosticato, presenta una chetoacidosi diabetica all’inizio. La chetoacidosi diabetica è definita dalla triade di iperglicemia (glicemia maggiore di 13,9 mmol/L/ (cioè 250 mg/dL), chetonemia/chetonuria e acidemia (pH uguale o inferiore a 7,3 e bicarbonato sierico uguale o inferiore a 15 mmol/L). Un lieve aumento delle concentrazioni di lipidi nel siero è una caratteristica comune del diabete incontrollato e non trattato, ma un’iperlipidemia significativa è sotto-riportata nei bambini. È spesso trascurato nella chetoacidosi diabetica. Segnaliamo una bambina di 2 anni con diabete mellito di tipo 1 di nuova insorgenza, che ha presentato una grave chetoacidosi diabetica e una grave iperlipidemia.
Rapporto del caso
Una bambina afro-americana di 2 anni precedentemente sana ha presentato con vomito e dolore addominale per 2 giorni. Non aveva febbre, tosse o diarrea. I suoi genitori hanno anche descritto la minzione frequente e l’aumento della sete associati alla perdita di peso, nonostante il buon appetito, durante gli ultimi tre mesi. L’anamnesi medica passata era irrilevante e l’anamnesi familiare era negativa per il diabete.
Al suo arrivo al dipartimento di emergenza, vomitava, era gravemente disidratata e aveva una respirazione rapida, ma poco profonda (iperventilazione con respiro di Kussmaul) con odore di acetone. Il suo esame fisico comprendeva una frequenza cardiaca di 146 battiti/min, una pressione sanguigna di 100/66 mmHg, una frequenza respiratoria di 26 respiri/min e una temperatura di 37,7 °C (99,8 °F). I suoi parametri di crescita (Figura 1) erano i seguenti: peso 11,8 kg (10-25° percentile) e lunghezza 86 cm (5° percentile). Le sue membrane mucose erano asciutte e il riempimento dei capillari era superiore a 5 secondi. I suoi capelli erano pallidi e radi. Il torace era chiaro all’auscultazione con suoni respiratori bilaterali. L’addome era morbido ma tenero. Non c’era epatosplenomegalia o masse palpabili. Il resto dell’esame era irrilevante.
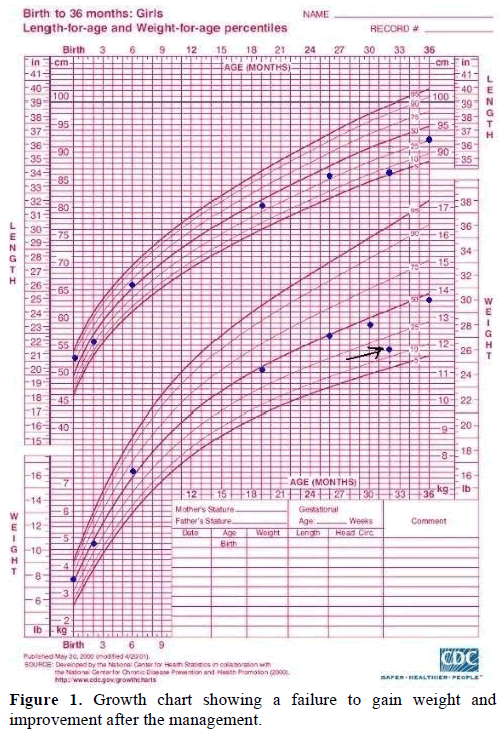
Figura 1. Grafico di crescita che mostra un mancato aumento di peso e miglioramento dopo la gestione.
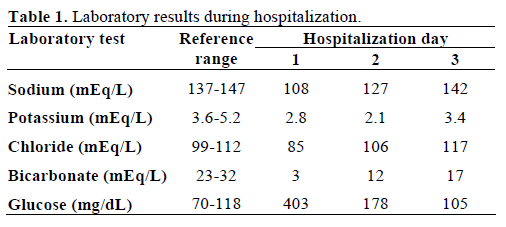
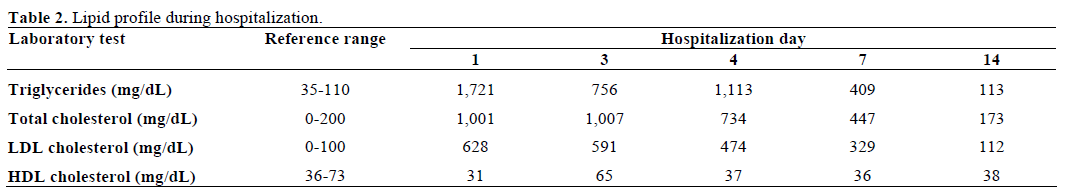
Il sangue prelevato per gli esami ha mostrato un aspetto lattiginoso (lipemico) (Figura 2). La chimica del siero ha mostrato valori anormali di glicemia (22.4 mmol/L, range di riferimento 3.8-6.5 mmol/L; 403 mg/dL, range di riferimento 70-118 mg/dL), sodio (108 mEq/L, range di riferimento 137-147 mEq/L), potassio (2.8 mEq/L, range di riferimento 3.6-5,2 mEq/L), cloruro (85 mEq/L, range di riferimento 99-112 mEq/L), bicarbonato (3 mEq/L, range di riferimento 23-32 mEq/L), e creatinina sierica (760,2 μmol/L, range di riferimento 53,0-114,9 μmol/L; 8,6 mg/dL, range di riferimento 0,6-1,3 mg/dL). D’altra parte, l’azoto ureico nel sangue era normale (4,3 mmol/L, range di riferimento 2,4-6,4 mmol/L; 12 mg/dL, range di riferimento 7-18 mg/dL). L’emogas iniziale ha mostrato un pH 6,89 (range di riferimento 7,32-7,42) e un deficit di basi di 29 mmol/L (range di riferimento -3,3-1,2 mmol/L). Gli acetoni sierici erano moderati e l’osmolalità sierica misurata era di 287 mosm/kg (range di riferimento 277-302 mosm/kg). Il livello di trigliceridi nel siero era 19,4 mmol/L (range di riferimento 0,39-1,24 mmol/L; 1.721 mg/dL, range di riferimento 35-110 mg/dL) e il colesterolo totale era 25,8 mmol/L (range di riferimento 0-5,1 mmol/L; 1.001 mg/dL, range di riferimento 0-200 mg/dL). La sua analisi delle urine ha mostrato un peso specifico di 1,027 (gamma di riferimento 1,005-1,035), +3 chetoni e glucosio. L’amilasi e la lipasi del siero erano normali. L’emoglobina glicosilata iniziale era del 24,9% (range di riferimento 0-5,7%). L’anticorpo anti decarbossilasi dell’acido glutammico (GAD65) era positivo, ma gli autoanticorpi delle cellule delle isole e dell’insulina erano negativi. I test di funzionalità tiroidea erano normali.

Figura 2. Aspetto lipemico del campione di sangue.
È stata valutata per la presenza di xantomi e lipemia retinica, entrambi assenti. È stata ricoverata nell’unità di terapia intensiva e trattata con fluidi per via endovenosa (rianimazione di volume) e infusione di insulina secondo il protocollo standard di chetoacidosi diabetica. L’iperlipidemia è migliorata con la risoluzione della chetoacidosi diabetica e gli elettroliti del siero sono tornati alla normalità. I valori di laboratorio, durante il corso dell’ospedale sono nelle tabelle 1 e 2. È stata dimessa 9 giorni dopo il ricovero. È stata seguita nella nostra clinica endocrina e il suo profilo lipidico è rimasto normale.
DISCUSSIONE
La chetoacidosi diabetica si verifica solitamente in pazienti con diabete non conforme. Può anche verificarsi in pazienti con diabete di nuova insorgenza che hanno una carenza assoluta di insulina. L’insulina non influenza solo il metabolismo del glucosio, ma anche quello delle proteine e dei lipidi. Lo squilibrio del metabolismo lipidico nel diabete mellito è noto da molti anni. L’insulina inibisce la lipolisi, diminuendo la fornitura di acidi grassi liberi al fegato per la chetogenesi. Aumenta anche la clearance dei chilomicroni ricchi di trigliceridi dalla circolazione attraverso la stimolazione della lipoproteina lipasi, un enzima extracellulare presente nella parete capillare della maggior parte dei tessuti, soprattutto adiposi, cardiaci e muscolo scheletrico. La lipoproteina lipasi scompone i trigliceridi in monogliceridi, acidi grassi e glicerolo. Gli acidi grassi generati vengono poi assorbiti dal muscolo e dal tessuto adiposo, in cui vengono ossidati o immagazzinati. I resti dei chilomicroni sono assorbiti dal fegato dove i lisosomi degradano l’apolipoproteina e l’estere del colesterolo in colesterolo, acido grasso e aminoacido. Il fegato, a sua volta, produce lipoproteine a bassissima densità (VLDL) composte da trigliceridi e le trasporta dal fegato ai tessuti periferici dove i trigliceridi vengono degradati dalla lipoproteina lipasi. Questo effetto tessuto-specifico dell’insulina sulla lipoproteina lipasi si traduce nella deviazione dei trigliceridi verso il tessuto adiposo per l’immagazzinamento.
In condizioni di ipoinsulinemia, come il diabete mellito incontrollato, la mobilitazione dei grassi è notevolmente aumentata e la loro eliminazione è diminuita con conseguente eccesso di acidi grassi liberi nel fegato. Questo aumento della lipolisi e la diminuzione dell’utilizzo e dell’escrezione portano all’iperlipidemia nei pazienti con carenza di insulina. I pazienti con nuova diagnosi di diabete mellito di tipo 1, che presentano una chetoacidosi diabetica, hanno una carenza assoluta di insulina che può provocare una grave iperlipidemia come quella osservata nel nostro paziente. Il riconoscimento di questa associazione è importante in quanto una grave ipertrigliceridemia può complicare la chetoacidosi diabetica con lo sviluppo di pancreatite, che può aumentare la morbilità e la mortalità. Dato che il tasso di mortalità è più alto nei bambini di età inferiore ai 5 anni che presentano una chetoacidosi diabetica, può essere prudente fare uno screening per l’iperlipidemia e, se presente, per la pancreatite.
Il livello di trigliceridi estremamente anormale può suggerire la presenza di deficit di LPL (iperlipidemia di tipo 1) o di deficit di apolipoproteina C II, soprattutto se le anomalie lipidiche persistono dopo la risoluzione della chetoacidosi diabetica e il controllo del diabete, e possono essere necessari studi genetici per confermare o escludere la diagnosi.
Similmente nel nostro paziente la creatinina sierica era significativamente elevata alla presentazione ma è tornata normale dopo la correzione di disidratazione e acidosi. Presumiamo che la disidratazione severa potrebbe essere stata la causa dello scompenso renale acuto.
CONCLUSIONE
Iperlipidemia severa che causa il siero lipemico in pazienti con chetoacidosi diabetica raramente segnalata in bambini meno di 3 anni di età. Il rischio di mortalità nella chetoacidosi diabetica grave è molto più alto nei bambini molto piccoli. La chetoacidosi diabetica associata a ipertrigliceridemia, come osservato nel nostro paziente, può aumentare ulteriormente questo rischio. L’identificazione precoce del diabete mellito di tipo 1 attraverso il riconoscimento di sintomi e segni, come poliuria, polidipsia, mancato aumento di peso nonostante l’aumento dell’appetito, può prevenire una grave morbilità e mortalità. Suggeriamo che il livello lipidico dovrebbe essere monitorato nei bambini indipendentemente dall’età, quando presentato con diabete scarsamente controllato o chetoacidosi diabetica.
Conflitto di interessi
Gli autori non hanno alcun potenziale conflitto di interessi
- Rewers A, Klingensmith G, Davis C, et al. Presenza di diabeticketoacidosis alla diagnosi di diabete mellito nei giovani: il Search forDiabetes in Youth Study. Pediatria. Maggio 2008;121(5):e1258-66.
- Smith CP, Firth D, Bennett S, et al. chetoacidosi che si verificano nei bambini diabetici appena diagnosticati e stabiliti. ActaPaediatr.May 1998;87(5):537-541.
- Rewers A, Chase HP, Mackenzie T, et al. Predittori di complicazioni acute nei bambini con diabete di tipo 1. JAMA. Maggio 152002;287(19):2511-2518.
- Trachtenbarg DE. Chetoacidosi diabetica. Am Fam Physician.2005;71:1705-1714.
- Potter JL, Stone RT. Iperlipidemia massiva nella chetoacidosi diabetica. L’importanza clinica del riconoscimento del laboratorio. ClinPediatr (Phila). 1975;14:412-413.
- Nyamugunduru G, Roper H. Un caso difficile. Diabete dipendente dall’insorgenza infantile con iperlipidemia grave.BMJ. 1997;314(7073):62-65.
- Farese RV Jr; Yost TJ; Eckel RH. Tessuto-specifica regolazione dell’attività della lipasi lipoproteica da insulina / glucosio in normale-weighthumans. Metabolismo 1991; 40:214-216.
- Hsu JH, Wu JR, Chao MC, Dai ZK, Chiou SS, Chen BH. Grave pancreatite iperlipidemica associata al diabete. ActaPaediatr.2006;95:378-379.
- Koul PB, Sussmane JB. Emergenze metaboliche iperglicemiche con pancreatite acuta in un bambino con noto diabete mellito insulino-dipendente. Eur J Emerg Med. 2005 ;12:309-311.
- Shenoy SD, Cody D, Rickett AB, Swift PG. Pancreatite acuta e la sua associazione con il diabete mellito nei bambini. J PediatrEndocrinolMetab. 2004;17:1667-1670.
- Nair S, Pitchumoni CS. Chetoacidosi diabetica, iperlipidemia e pancreatite acuta: il triangolo enigmatico. Am J Gastroenterol.1997;92:1560-1561.
- Karagianni C, Stabouli S, Roumeliotou K, Traeger-Synodinos J,Kavazarakis E, Gourgiotis D, et al. Severe hypertriglyceridaemia indiabetic ketoacidosis: clinical and genetic study. Diabet Med.2004;21:380-382.