Monosaccaride
Con poche eccezioni (ad esempio, il desossiribosio), i monosaccaridi hanno questa formula chimica: (CH2O)x, dove convenzionalmente x ≥ 3. I monosaccaridi possono essere classificati in base al numero x di atomi di carbonio che contengono: trioso (3), tetroso (4), pentoso (5), esoso (6), eptosio (7), e così via.
Il glucosio, usato come fonte di energia e per la sintesi di amido, glicogeno e cellulosa, è un esoso. Il ribosio e il desossiribosio (rispettivamente nell’RNA e nel DNA) sono zuccheri pentosi. Esempi di eptosi includono i chetosi, il mannoeptulosio e il sedoeptulosio. I monosaccaridi con otto o più carboni si osservano raramente perché sono abbastanza instabili. Nelle soluzioni acquose i monosaccaridi esistono come anelli se hanno più di quattro carboni.
Monosaccaridi a catena lineareModifica
I monosaccaridi semplici hanno uno scheletro di carbonio lineare e non ramificato con un gruppo funzionale carbonilico (C=O), e un gruppo idrossilico (OH) su ciascuno degli atomi di carbonio rimanenti. Pertanto, la struttura molecolare di un semplice monosaccaride può essere scritta come H(CHOH)n(C=O)(CHOH)mH, dove n + 1 + m = x; così che la sua formula elementare è CxH2xOx.
Per convenzione, gli atomi di carbonio sono numerati da 1 a x lungo la spina dorsale, partendo dall’estremità che è più vicina al gruppo C=O. I monosaccaridi sono le unità più semplici dei carboidrati e la forma più semplice di zucchero.
Se il carbonile è in posizione 1 (cioè, n o m è zero), la molecola inizia con un gruppo formile H(C=O)- ed è tecnicamente un’aldeide. In questo caso, il composto è definito un aldoso. Altrimenti, la molecola ha un gruppo cheto, un carbonile -(C=O)- tra due carboni; allora è formalmente un chetone, e viene chiamato chetoso. I chetosi di interesse biologico di solito hanno il carbonile in posizione 2.
Le varie classificazioni di cui sopra possono essere combinate, dando luogo a nomi come “aldoesoso” e “chetotrioso”.
Una nomenclatura più generale per i monosaccaridi a catena aperta combina un prefisso greco per indicare il numero di carboni (tri-, tetr-, pent-, hex-, ecc.) con i suffissi “-ose” per gli aldosi e “-ulose” per i chetosi. In quest’ultimo caso, se il carbonile non è in posizione 2, la sua posizione è allora indicata da un infisso numerico. Così, per esempio, H(C=O)(CHOH)4H è pentoso, H(CHOH)(C=O)(CHOH)3H è pentuloso, e H(CHOH)2(C=O)(CHOH)2H è pent-3-uloso.
Stereoisomeri a catena apertaModifica
Due monosaccaridi con grafici molecolari equivalenti (stessa lunghezza della catena e stessa posizione carbonilica) possono ancora essere stereoisomeri distinti, le cui molecole differiscono nell’orientamento spaziale. Questo accade solo se la molecola contiene un centro stereogenico, in particolare un atomo di carbonio che è chirale (collegato a quattro distinte sottostrutture molecolari). Questi quattro legami possono avere una qualsiasi delle due configurazioni nello spazio distinte dalla loro mano. In un semplice monosaccaride a catena aperta, ogni carbonio è chirale tranne il primo e l’ultimo atomo della catena, e (nei chetosi) il carbonio con il gruppo cheto.
Per esempio, il trichetoso H(CHOH)(C=O)(CHOH)H (glicerone, diidrossiacetone) non ha centro stereogenico, e quindi esiste come singolo stereoisomero. L’altro trioso, l’aldoso H(C=O)(CHOH)2H (gliceraldeide), ha un carbonio chirale – quello centrale, il numero 2 – che è legato ai gruppi -H, -OH, -C(OH)H2, e -(C=O)H. Pertanto, esiste come due stereoisomeri le cui molecole sono immagini speculari l’una dell’altra (come un guanto sinistro e uno destro). I monosaccaridi con quattro o più carboni possono contenere più carboni chirali, quindi in genere hanno più di due stereoisomeri. Il numero di stereoisomeri distinti con lo stesso diagramma è limitato da 2c, dove c è il numero totale di carboni chirali.
La proiezione di Fischer è un modo sistematico di disegnare la formula scheletrica di un monosaccaride aciclico in modo che la mano di ogni carbonio chirale sia ben specificata. Ogni stereoisomero di un semplice monosaccaride a catena aperta può essere identificato dalle posizioni (destra o sinistra) nel diagramma di Fischer degli idrossili chirali (gli idrossili attaccati ai carboni chirali).
La maggior parte degli stereoisomeri sono essi stessi chirali (distinti dalle loro immagini speculari). Nella proiezione di Fischer, due isomeri speculari differiscono per avere le posizioni di tutti gli idrossili chirali invertiti da destra a sinistra. Gli isomeri speculari sono chimicamente identici in ambienti non chirali, ma di solito hanno proprietà biochimiche molto diverse e si presentano in natura.
Mentre la maggior parte degli stereoisomeri possono essere disposti in coppie di forme speculari, ci sono alcuni stereoisomeri non chirali che sono identici alle loro immagini speculari, nonostante abbiano centri chirali. Questo accade quando il grafico molecolare è simmetrico, come nei 3-chetocentosi H(CHOH)2(CO)(CHOH)2H, e le due metà sono immagini speculari l’una dell’altra. In questo caso, la specularità è equivalente a una rotazione di mezzo giro. Per questo motivo, ci sono solo tre distinti stereoisomeri di 3-chetocentosio, anche se la molecola ha due carboni chirali.
Stereoisomeri distinti che non sono immagini speculari l’uno dell’altro di solito hanno proprietà chimiche diverse, anche in ambienti non chirali. Pertanto, ad ogni coppia speculare e ad ogni stereoisomero non chirale può essere dato un nome specifico di monosaccaride. Per esempio, ci sono 16 distinti stereoisomeri di aldoesosi, ma il nome “glucosio” indica una specifica coppia di aldoesosi speculari. Nella proiezione di Fischer, uno dei due isomeri del glucosio ha l’ossidrile a sinistra su C3, e a destra su C4 e C5; mentre l’altro isomero ha lo schema invertito. Questi nomi specifici dei monosaccaridi hanno abbreviazioni convenzionali di tre lettere, come “Glu” per il glucosio e “Thr” per il treosio.
Generalmente, un monosaccaride con n carboni asimmetrici ha 2n stereoisomeri. Il numero di stereoisomeri a catena aperta per un monosaccaride aldoso è maggiore di uno rispetto a quello di un monosaccaride chetosio della stessa lunghezza. Ogni chetosi avrà 2(n-3) stereoisomeri dove n > 2 è il numero di carboni. Ogni aldoso avrà 2(n-2) stereoisomeri dove n > 2 è il numero di carboni. Questi sono anche chiamati epimeri che hanno la diversa disposizione dei gruppi -OH e -H agli atomi di carbonio asimmetrici o chirali (questo non si applica a quei carboni che hanno il gruppo funzionale carbonile).
Configurazione dei monosaccaridiModifica
Come molte molecole chirali, i due stereoisomeri della gliceraldeide ruoteranno gradualmente la direzione di polarizzazione della luce polarizzata linearmente al suo passaggio, anche in soluzione. I due stereoisomeri sono identificati con i prefissi D- e L-, secondo il senso di rotazione: La D-gliceraldeide è destrorotatoria (ruota l’asse di polarizzazione in senso orario), mentre la L-gliceraldeide è levorotatoria (lo ruota in senso antiorario).

I prefissi D- e L- sono usati anche con altri monosaccaridi, per distinguere due particolari stereoisomeri che sono immagini speculari l’uno dell’altro. A questo scopo, si considera il carbonio chirale più lontano dal gruppo C=O. I suoi quattro legami devono collegarsi a -H, -OH, -C(OH)H e al resto della molecola. Se la molecola può essere ruotata nello spazio in modo che le direzioni di questi quattro gruppi corrispondano a quelle dei gruppi analoghi nel C2 della D-gliceraldeide, allora l’isomero riceve il prefisso D-. Altrimenti, riceve il prefisso L-.
Nella proiezione Fischer, i prefissi D- e L- specificano la configurazione dell’atomo di carbonio che è il secondo dal basso: D- se l’idrossile è sul lato destro, e L- se è sul lato sinistro.
Nota che i prefissi D- e L- non indicano la direzione di rotazione della luce polarizzata, che è un effetto combinato della disposizione in tutti i centri chirali. Tuttavia, i due enantiomeri ruoteranno sempre la luce in direzioni opposte, della stessa quantità. Vedi anche sistema D/L.
Ciclizzazione dei monosaccaridiModifica
Un monosaccaride spesso passa dalla forma aciclica (a catena aperta) a una forma ciclica, attraverso una reazione di addizione nucleofila tra il gruppo carbonilico e uno degli idrossili della stessa molecola. La reazione crea un anello di atomi di carbonio chiuso da un atomo di ossigeno a ponte. La molecola risultante ha un gruppo emiacetale o emichetale, a seconda che la forma lineare fosse un aldoso o un chetoso. La reazione si inverte facilmente, producendo la forma originale a catena aperta.
In queste forme cicliche, l’anello di solito ha cinque o sei atomi. Queste forme sono chiamate rispettivamente furanosi e piranosi – per analogia con il furano e il pirano, i composti più semplici con lo stesso anello carbonio-ossigeno (anche se mancano i doppi legami di queste due molecole). Per esempio, il glucosio aldoesoso può formare un legame emiacetale tra l’idrossile sul carbonio 1 e l’ossigeno sul carbonio 4, dando origine a una molecola con un anello a 5 membri, chiamata glucofuranosio. La stessa reazione può avvenire tra i carboni 1 e 5 per formare una molecola con un anello di 6 membri, chiamata glucopiranosio. Le forme cicliche con un anello a sette atomi (lo stesso dell’oxepane), che si incontrano raramente, sono chiamate eptosi.


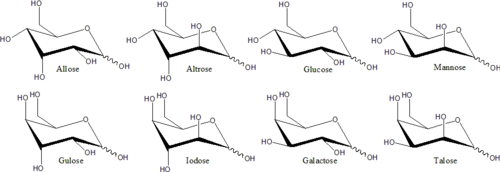
Per molti monosaccaridi (incluso il glucosio), le forme cicliche predominano, allo stato solido e in soluzione, e quindi lo stesso nome viene comunemente usato per gli isomeri a catena aperta e chiusa. Così, per esempio, il termine “glucosio” può indicare il glucofuranosio, il glucopiranosio, la forma a catena aperta, o una miscela dei tre.
La ciclizzazione crea un nuovo centro stereogenico al carbonio carbonilico. Il gruppo -OH che sostituisce l’ossigeno del carbonile può finire in due posizioni distinte rispetto al piano medio dell’anello. Così ogni monosaccaride a catena aperta produce due isomeri ciclici (anomeri), indicati dai prefissi α- e β-. La molecola può cambiare tra queste due forme per un processo chiamato mutarotazione, che consiste in un’inversione della reazione di formazione dell’anello seguita da un’altra formazione dell’anello.
Proiezione di HaworthModifica
La struttura stereochimica di un monosaccaride ciclico può essere rappresentata in una proiezione di Haworth. In questo diagramma, l’α-isomero per la forma piranosica di un D-aldoesoso ha il -OH del carbonio anomerico sotto il piano degli atomi di carbonio, mentre il β-isomero ha il -OH del carbonio anomerico sopra il piano. I piranosi adottano tipicamente una conformazione a sedia, simile a quella del cicloesano. In questa conformazione, l’α-isomero ha il -OH del carbonio anomerico in posizione assiale, mentre il β-isomero ha il -OH del carbonio anomerico in posizione equatoriale (considerando gli zuccheri D-aldoesosi).
-
α-D-Glucopiranosio
-
β-D-Glucopiranosio