Polmonite nosocomiale
(Questo capitolo è stato ristampato con il permesso di Williams MV, Hayward R: Comprehensive Hospital Medicine, 1st edition. Philadelphia, WB Saunders, in press.)
Background
La polmonite nosocomiale (NP) è la principale causa di mortalità tra i pazienti che muoiono per infezioni contratte in ospedale. Definita come polmonite che si verifica 48 ore o più dopo il ricovero in ospedale, la NP include anche il sottoinsieme della polmonite associata al ventilatore (VAP), definita come polmonite che si sviluppa da 48 a 72 ore dopo l’inizio della ventilazione meccanica. L’incidenza della NP è compresa tra 5 e 15 casi per 1000 ricoveri ospedalieri. La polmonite associata all’assistenza sanitaria (HCAP), parte del continuum della NP, descrive una percentuale sempre più comune di polmonite che si sviluppa fuori dall’ospedale (Tabella I) (1). Tipicamente affliggono le persone in una casa di cura o in un ambiente di vita assistita, questi pazienti sono a rischio di microrganismi resistenti agli antibiotici e dovrebbero essere affrontati in modo simile ai casi di polmonite nosocomiale piuttosto che alla polmonite acquisita in comunità. La maggior parte dei dati che informano le nostre decisioni di diagnosi e trattamento della NP provengono da studi effettuati su pazienti ventilati meccanicamente e sono estrapolati per fare raccomandazioni per i pazienti non ventilati.
La mortalità attribuibile alla NP è discussa, ma può arrivare fino al 30%. La presenza di una polmonite nosocomiale aumenta la durata della degenza ospedaliera in media di 7-10 giorni e, nel caso della VAP, si stima un costo tra i 10.000 e i 40.000 dollari per caso (2).
Valutazione
Presentazione clinica
Segni e sintomi
La polmonite nosocomiale viene solitamente diagnosticata sulla base di motivi clinici. I sintomi e i segni tipici consistono in febbre, tosse con espettorato e mancanza di respiro in presenza di ipossia e un nuovo infiltrato sulla radiografia del torace (CXR). Negli anziani, i segni possono essere più sottili e il delirio, la febbre o la leucocitosi in assenza di tosse dovrebbero far scattare la sua considerazione. La probabilità di NP aumenta tra i pazienti con fattori di rischio per microaspirazione, colonizzazione orofaringea o crescita eccessiva di organismi resistenti (Tabella II) (3).
Diagnosi differenziale
Prima di stabilire una diagnosi di NP, dovrebbero essere considerate cause alternative di febbre, ipossia e infiltrati polmonari. Più comunemente, queste includono l’embolo polmonare, l’edema polmonare o l’atelettasia. Fonti infettive alternative, come le infezioni del tratto urinario, della pelle e dei tessuti molli, e le infezioni legate ai dispositivi (cioè i cateteri venosi centrali) sono comuni nei pazienti ospedalizzati e devono essere escluse prima di diagnosticare la polmonite nosocomiale.
 clicca per la versione grande
clicca per la versione grande
clicca per la versione grande
Diagnosi
Le strategie diagnostiche per la NP cercano di confermare la diagnosi e identificare un patogeno eziologico, permettendo così una terapia antibiotica tempestiva, efficace e snella. Sfortunatamente, non esiste un consenso sull’approccio migliore per diagnosticare la polmonite nosocomiale. Dopo aver ottenuto un emocromo completo e le emocolture, è possibile scegliere tra un approccio diagnostico clinico o microbiologico alla diagnosi. Una diagnosi clinica si basa su un infiltrato radiografico nuovo o progressivo insieme a segni di infezione come febbre, leucocitosi o espettorato purulento. La diagnosi clinica è sensibile, ma è probabile che porti a un uso eccessivo di antibiotici. L’approccio microbiologico richiede il campionamento delle secrezioni del tratto respiratorio e può ridurre l’uso inappropriato di antibiotici, ma richiede più tempo e può non essere disponibile in tutti gli ospedali.
Studi preferenziali
L’approccio microbiologico alla diagnosi si basa sull’uso di colture quantitative o semi-quantitative per creare soglie per il trattamento antibiotico. Le colture batteriche che dimostrano un livello di crescita superiore alle soglie descritte di seguito garantiscono il trattamento, mentre quelle al di sotto dovrebbero innescare la sospensione o l’interruzione degli antibiotici.
Approcci broncoscopici: Il lavaggio broncoalveolare (BAL) con un cutoff di 10 (4) organismi/mL o la spazzola per campioni protetti (PSB) con un cutoff di 10 (3) organismi/mL sono considerati i test diagnostici più specifici se eseguiti prima di iniziare gli antibiotici, o prima di cambiare gli antibiotici se un paziente li sta già ricevendo. In pazienti clinicamente stabili, gli antibiotici possono essere tranquillamente sospesi se la crescita batterica scende sotto le soglie. Se le colture sono positive, la terapia antibiotica dovrebbe essere personalizzata per colpire l’organismo identificato. L’approccio broncoscopico è favorito nei pazienti che sono ventilati meccanicamente, sviluppano la polmonite tardivamente durante la degenza (>5-7 giorni), sono a rischio di patogeni insoliti, stanno fallendo la terapia o si sospetta che abbiano una diagnosi alternativa.
Approcci non broncoscopici: Gli aspirati endotracheali qualitativi (ETA) hanno dimostrato di essere abbastanza sensibili nei pazienti ventilati, identificano regolarmente gli organismi che possono essere trovati successivamente tramite BAL o PSB e, se negativi, dovrebbero portare a sospendere gli antibiotici. Gli aspirati endotracheali quantitativi con un cutoff di 10 (6) organismi/mL sono spesso incoraggiati per ridurre l’uso eccessivo di antibiotici, ma i risultati dovrebbero essere interpretati con cautela, poiché hanno solo una sensibilità e specificità di circa il 75% (1). Si dovrebbe prendere in considerazione la possibilità di sospendere gli antibiotici in un paziente clinicamente stabile con un ETA quantitativo negativo se gli antibiotici non sono stati cambiati nelle 72 ore precedenti. Molte unità di terapia intensiva hanno iniziato a eseguire il campionamento in cieco delle secrezioni del tratto respiratorio inferiore con cateteri di aspirazione (PSB cieco, mini-BAL cieco). Queste tecniche possono essere eseguite a tutte le ore da terapisti respiratori o infermieri addestrati, forniscono dati colturali simili a quelli della broncoscopia e possono essere più sicuri e meno costosi della broncoscopia. In generale, le tecniche non broncoscopiche sono preferite nei pazienti che non sono ventilati meccanicamente. Il campionamento dell’espettorato, anche se facile da ottenere, non è stato ben studiato in NP. Tuttavia, nei pazienti in cui le tecniche broncoscopiche o altre tecniche non broncoscopiche non sono fattibili, il campionamento dell’espettorato può essere eseguito per identificare organismi potenzialmente resistenti e aiutare a personalizzare la terapia.
Opzioni alternative
Clinical Pulmonary Infection Score-Combinazione di approcci clinici e microbiologici
La diagnosi clinica di polmonite nosocomiale (nuovo infiltrato + febbre, leucocitosi, o espettorato purulento) porta probabilmente a un uso eccessivo di antibiotici, ma perseguire una diagnosi broncoscopica è invasivo, costoso e richiede competenze tecniche. L’ETA quantitativo, il PSB cieco e il BAL cieco discussi sopra sono esempi di alcuni compromessi che evitano la necessità della broncoscopia, ma aggiungono dati microbiologici nel tentativo di prevenire un eccesso di terapia antibiotica. Anche la combinazione formale di approcci diagnostici (clinici + microbiologici) può essere utile. Una di queste opzioni è l’uso del punteggio di infezione polmonare clinica (CPIS), che combina dati clinici, radiografici, fisiologici e microbiologici in un risultato numerico. I punteggi >6 hanno dimostrato di correlarsi bene con il BAL quantitativo (4). Studi più recenti, tuttavia, hanno suggerito una specificità inferiore che potrebbe ancora comportare un uso eccessivo di antibiotici, ma questo approccio rimane più accurato di un approccio clinico generale. Usare il CPIS in serie nel momento in cui si sospetta la NP e di nuovo a 72 ore può essere più utile. I pazienti con un basso sospetto clinico iniziale di polmonite (CPIS di 6 o meno) potrebbero essere tranquillamente sospesi dagli antibiotici a 72 ore se il CPIS rimane basso (5). Tale strategia può essere utile in contesti in cui non sono disponibili modalità diagnostiche più sofisticate.
Molti studi sui marcatori biologici dell’infezione hanno tentato di trovare un mezzo non invasivo, rapido e accurato per determinare chi ha bisogno di antibiotici per una presunta NP. Sfortunatamente, i risultati sono stati in gran parte deludenti. Più recentemente, la misurazione di un recettore solubile di attivazione espresso sulle cellule mieloidi (sTREM-1) che è upregolato nel contesto dell’infezione ha dimostrato di migliorare la nostra capacità di diagnosticare accuratamente NP. La misurazione di sTREM-1 è stata sensibile al 98% e specifica al 90% per la diagnosi di polmonite in pazienti sottoposti a ventilazione meccanica (6). Anche se promettente, sono necessari più dati prima che questo test possa essere raccomandato per l’uso di routine.
Gestione
Trattamento iniziale
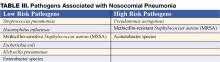
L’inizio precoce di un’adeguata terapia antibiotica empirica (cioè, gli antibiotici somministrati hanno dimostrato di essere attivi contro tutti gli organismi isolati) è associato a una migliore sopravvivenza rispetto alla terapia iniziale inadeguata (1,7). Gli antibiotici dovrebbero essere iniziati immediatamente dopo aver ottenuto campioni di sangue ed espettorato per la coltura e non dovrebbero essere negati in caso di ritardo nei test diagnostici. La necessità di scegliere gli antibiotici in modo rapido e veloce guida l’uso di antibiotici ad ampio spettro. Nel tentativo di evitare un uso eccessivo e non necessario di antibiotici ad ampio spettro, la terapia dovrebbe essere basata sul rischio di patogeni multiresistenti (MDR). Identificare i pazienti a basso rischio per i patogeni MDR in base a criteri clinici permette una terapia antibiotica più ristretta, ma efficace. I pazienti a basso rischio comprendono quelli che sviluppano la polmonite all’inizio del ricovero (<5-7 giorni), non sono immunocompromessi, non hanno avuto precedenti antibiotici ad ampio spettro e non hanno fattori di rischio per l’HCAP (Tabella I) (1,7). In questi pazienti gli antibiotici dovrebbero mirare ai comuni organismi acquisiti in comunità (Tabella III – patogeni a basso rischio). La terapia antibiotica iniziale appropriata potrebbe includere una cefalosporina di terza generazione o un beta-lattamico/inibitore delle beta-lattamasi. In alcune comunità o reparti ospedalieri l’incidenza della resistenza alla meticillina tra gli isolati di Staphylococcus aureus (MRSA) può essere abbastanza alta da giustificare una terapia empirica iniziale con vancomicina o linezolid.
 clicca per la versione grande
clicca per la versione grande
clicca per la versione grande
Purtroppo, oggi i pazienti ospedalizzati sempre più complessi difficilmente sono “a basso rischio”, soprattutto nelle unità di terapia intensiva.
I pazienti che non soddisfano i criteri di basso rischio sono considerati ad alto rischio per i patogeni MDR (Tabella III – patogeni ad alto rischio). La terapia empirica iniziale deve essere ampia e dovrebbe includere un agente antipseudomonico (cefepime o imipenem o inibitore di beta-lattamici/beta-lattamasi) più un fluorochinolone o un aminoglicoside più vancomicina o linezolid. La terapia empirica iniziale specifica dovrebbe essere dettata dai modelli di resistenza locali, dal costo e dalla disponibilità degli agenti preferiti. Quando viene iniziata una terapia ad ampio spettro, diventa imperativo che gli antibiotici vengano “de-escalati” per limitare l’uso eccessivo di antibiotici. La terapia di de-escalation si concentra sul restringimento dello spettro antibiotico basato sui risultati della coltura e sulla limitazione della durata complessiva della terapia. Gli ospedalieri dovrebbero mirare a realizzare tale de-escalation entro 48-72 ore dall’inizio degli antibiotici ad ampio spettro.
 clicca per la versione grande
clicca per la versione grande
clicca per la versione grande
Trattamento successivo
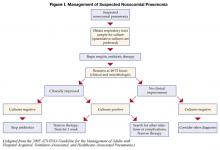
I pazienti avviati alla terapia antibiotica empirica iniziale per presunta polmonite nosocomiale dovrebbero essere rivalutati a 48-72 ore. In particolare, si dovrebbero controllare le colture e valutare la risposta clinica al trattamento. La Figura I descrive un algoritmo per guidare il trattamento (1). Nei pazienti clinicamente stabili e con colture del tratto respiratorio inferiore negative, gli antibiotici possono essere sospesi. I pazienti con colture positive dovrebbero avere antibiotici su misura, o “de-escalati” in base agli organismi identificati. In generale, dovrebbe essere usato l’antibiotico a spettro più stretto che è attivo contro i batteri isolati. L’uso della terapia combinata per gli organismi gram negativi (due o più antibiotici attivi contro un isolato batterico) è ampiamente praticato per ottenere una sinergia, o prevenire lo sviluppo di resistenza. Tuttavia, in assenza di neutropenia, la terapia combinata non ha dimostrato di essere superiore alla monoterapia (8), ed è preferibile la monoterapia. Anche l’isolamento di MRSA da un campione respiratorio dovrebbe portare all’uso della monoterapia. Mentre alcuni studi hanno suggerito che il linezolid può essere superiore alla vancomicina per la polmonite da MRSA, questo risultato deve essere convalidato in studi prospettici.
Un secondo componente della de-escalation è la riduzione della durata totale della terapia. Il CPIS può essere usato per ridurre la durata della terapia nei pazienti a basso rischio di polmonite. I ricercatori di un centro medico degli affari dei veterani hanno randomizzato i pazienti sospettati di avere NP, ma che avevano un punteggio CPIS < 6, al trattamento per 10-21 giorni o alla terapia breve. I pazienti che hanno ricevuto la terapia breve sono stati rivalutati al giorno 3, e se il loro punteggio CPIS è rimasto < 6, gli antibiotici sono stati fermati (5). Il gruppo di terapia breve non ha avuto alcuna differenza di mortalità rispetto al gruppo di trattamento standard, ma ha avuto un uso minore di antibiotici, soggiorni più brevi in terapia intensiva e ha avuto meno probabilità di sviluppare una superinfezione o un’infezione con un organismo resistente. Se il CPIS non viene utilizzato, o se i pazienti sono ritenuti a più alto rischio o si dimostra in modo convincente di avere la NP, un ciclo più breve di terapia può ancora essere preferito. Un grande studio randomizzato ha dimostrato che 8 giorni di terapia antibiotica per i pazienti con VAP hanno portato a risultati clinici simili rispetto a 15 giorni di terapia. Inoltre, la terapia antibiotica di durata più breve è stata associata a una minore probabilità di sviluppare infezioni successive con patogeni multi-resistenti. Un sottogruppo di pazienti nel gruppo di trattamento di 8 giorni infettati da bacilli gram negativi non fermentanti (ad esempio, Pseudomonas aeruginosa) ha avuto un tasso di recidiva dell’infezione polmonare più alto, ma grazie alla sorveglianza aggressiva, questo non si è tradotto in un rischio di mortalità più elevato in questo sottogruppo di pazienti (9).
In sintesi, il trattamento dei pazienti con sospetta NP inizia con l’inizio immediato di antibiotici e la raccolta di secrezioni respiratorie. Mentre i pazienti a basso rischio possono ricevere una terapia a spettro più stretto, la maggior parte dei pazienti richiederà un’ampia terapia empirica iniziale. Il regime antibiotico, tuttavia, dovrebbe essere ristretto a 48-72 ore in base ai risultati microbiologici se il paziente sta migliorando. La durata complessiva del trattamento di 1 settimana è sicura ed efficace con meno possibilità di promuovere la crescita di organismi resistenti. Nel sottogruppo di pazienti con infezioni pseudomonali, il trattamento di 1 settimana dovrebbe essere seguito da una sorveglianza attiva per le recidive, o in alternativa, il trattamento può essere esteso a due settimane.
Prognosi
Una volta iniziato il trattamento per NP, il miglioramento clinico è di solito visto entro 48-72 ore. C’è poco supporto per seguire la risposta microbiologica (clearance delle colture positive) o la risposta attraverso la radiografia del torace. La radiografia del torace spesso è in ritardo rispetto alla risposta clinica, tuttavia, un CXR in netto peggioramento (> aumento del 50% dell’infiltrato) entro le prime 48 ore può indicare il fallimento del trattamento. La risoluzione clinica misurata dalla temperatura, dalla conta dei globuli bianchi e dall’ossigenazione avviene di solito entro 6-7 giorni (10). Il mancato miglioramento dell’ossigenazione entro 72 ore ha dimostrato di essere predittivo del fallimento del trattamento.
La mortalità complessiva nei pazienti con NP è del 30-70%, in gran parte dovuta a gravi malattie comorbide nella popolazione a rischio. Tassi di mortalità più alti sono visti nei pazienti con VAP e organismi resistenti. La mortalità attribuibile all’episodio di NP è circa il 30%, e può essere ridotta al <15% con un’appropriata terapia antibiotica (1).
Prevenzione
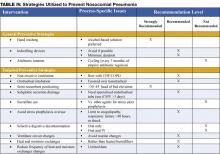
Le strategie preventive sono dirette a ridurre l’incidenza complessiva delle complicazioni infettive nei pazienti ospedalizzati, o sono specificamente mirate a ridurre l’incidenza della polmonite nosocomiale (3). La maggior parte dei dati a sostegno delle strategie preventive è limitata ai pazienti in terapia intensiva e, in particolare, ai pazienti sottoposti a ventilazione meccanica. Tuttavia, molti dei principi preventivi possono essere estrapolati alla popolazione non in terapia intensiva. Le strategie preventive sono evidenziate nella tabella IV (pagina 18).
Strategie preventive generali
Le strategie preventive generali mirano a evitare la contaminazione dei pazienti con organismi resistenti agli antimicrobici che esistono negli ospedali, o a mitigare l’emergenza di organismi resistenti agli antimicrobici in primo luogo. La prevenzione della diffusione iatrogena di organismi resistenti dipende da un’attenta igiene delle mani. Il lavaggio delle mani prima e dopo il contatto con il paziente riduce l’incidenza delle infezioni nosocomiali. I risciacqui per le mani a base di alcool posizionati al lato del letto possono effettivamente essere superiori all’acqua e al sapone e, inoltre, migliorano la conformità all’igiene delle mani.
Minimizzare l’uso di dispositivi indwelling (linee centrali, cateteri urinari) riduce anche l’emergere di organismi resistenti. Quando questi dispositivi sono necessari, è fondamentale concentrarsi sulla loro rimozione tempestiva. Il controllo dell’uso di antibiotici è stato centrale per molte strategie preventive. L’uso prolungato o non necessario di antibiotici ad ampio spettro è fortemente associato allo sviluppo e alla colonizzazione di organismi resistenti. Le strategie che si concentrano sulla de-escalation antibiotica aggressiva (descritta sopra) sono uno strumento preventivo chiave. Alcune istituzioni hanno avuto successo con la restrizione o la rotazione degli antibiotici, ma mancano dati a lungo termine sull’efficacia di queste tecniche.
 clicca per la versione grande
clicca per la versione grande
clicca per la versione grande
Strategie preventive mirate
Le strategie preventive per abbassare l’incidenza della NP si concentrano sulla riduzione dei fattori di rischio per la colonizzazione orofaringea o gastrica e la successiva aspirazione di secrezioni orofaringee o gastriche contaminate (1,3,7,11).
L’intubazione endotracheale è uno dei più importanti fattori di rischio per la NP nei pazienti che richiedono supporto ventilatorio. L’uso della ventilazione non invasiva (NIV) o della ventilazione con maschera a pressione positiva in gruppi selezionati di pazienti è stato efficace nel prevenire la polmonite nosocomiale. La ventilazione non invasiva ha avuto più successo nei pazienti con esacerbazioni acute della malattia polmonare ostruttiva cronica (BPCO) e nell’edema polmonare secondario all’insufficienza cardiaca congestizia (CHF) e dovrebbe essere considerata in pazienti adeguatamente selezionati. Quando è necessaria l’intubazione, l’uso dell’intubazione nasotracheale dovrebbe essere evitato a causa dei più alti tassi di NP rispetto all’intubazione orotracheale.
Il posizionamento supino può contribuire allo sviluppo di NP, probabilmente a causa di un aumentato rischio di reflusso gastrico e conseguente aspirazione. Gli studi sul posizionamento semisdraiato (elevazione della testa del letto > di 45 gradi) hanno mostrato meno reflusso, meno aspirazione e, in un recente studio di controllo randomizzato, una riduzione significativa del tasso di VAP (12). L’elevazione della testa del letto è chiaramente indicata nei pazienti ventilati meccanicamente ed è anche probabile che sia di beneficio per tutti i pazienti a rischio di aspirazione e successiva NP, anche se questa tecnica non è stata ben studiata nei pazienti non ventilati.
Il drenaggio delle secrezioni sottoglottiche (SSD) comporta la rimozione delle secrezioni raccolte sopra la cuffia di un tubo endotracheale specializzato che potrebbero altrimenti fuoriuscire nel polmone. Una meta-analisi di cinque studi che valutano questa nuova tecnologia ha mostrato riduzioni significative nell’incidenza di VAP. L’uso della SSD dovrebbe essere considerato per l’uso in pazienti che richiedono più di 3 giorni di ventilazione meccanica (13).
I farmaci usati per la profilassi dell’ulcera da stress che aumentano il pH gastrico – come gli antagonisti H2 e gli antiacidi – permettono la colonizzazione del tratto gastrointestinale superiore da parte di organismi potenzialmente patogeni e quindi aumentano il rischio di NP. Si ritiene che l’uso del sucralfato invece degli antagonisti H2 porti a una minore alcalinizzazione dello stomaco e a una minore crescita batterica. La capacità del sucralfato di prevenire la polmonite nosocomiale, tuttavia, non è stata ben dimostrata e il suo uso di routine non è raccomandato (14). Invece, gli sforzi dovrebbero essere mirati a limitare l’uso della profilassi dell’ulcera da stress alle popolazioni ad alto rischio di sanguinamento clinicamente significativo, cioè i pazienti con coagulopatia e insufficienza ventilatoria prolungata. La maggior parte dei pazienti che non sono in terapia intensiva non dovrebbero ricevere la profilassi dell’ulcera da stress. Il rischio di NP legato all’uso di inibitori della pompa protonica non è stato ben studiato.
La decontaminazione digestiva selettiva (SDD) comporta la sterilizzazione dell’orofaringe e del tratto gastrointestinale nei pazienti ventilati meccanicamente, al fine di prevenire l’aspirazione di un gran numero di organismi potenzialmente patogeni e la successiva VAP. La maggior parte delle valutazioni di SDD hanno coinvolto l’applicazione orale (e talvolta gastrica) di polimixina topica, aminoglicoside e amfotericina. In molti casi, sono stati aggiunti brevi cicli di antibiotici IV. Almeno 10 meta-analisi hanno dimostrato una riduzione del rischio di VAP con l’uso di SDD. L’aggiunta di antibiotici per via endovenosa può anche fornire un beneficio in termini di mortalità. Tuttavia, il rischio a lungo termine per l’emergere di organismi resistenti e i dati insufficienti sul rapporto costo-efficacia della SDD impediscono la sua raccomandazione per l’uso di routine (14).
Ci sono diverse strategie preventive mirate a ridurre l’aspirazione di contaminanti nei circuiti del ventilatore, nei filtri e nei tubi. Le strategie raccomandate, elencate nella Tabella III, pagina 16, includono l’evitare i cambi di routine dei circuiti del ventilatore (cambiare i tubi solo quando visibilmente contaminati o per un nuovo paziente), l’uso di scambiatori di calore e umidità piuttosto che umidificatori riscaldati, e la riduzione della frequenza dei cambi degli scambiatori di calore e umidità (1,11,14).
Piani di dimissione/follow-up
I pazienti dovrebbero essere seguiti in ospedale finché è chiaro che stanno rispondendo alla terapia e migliorando clinicamente. C’è stata una valutazione limitata delle strategie per passare rapidamente i pazienti alla terapia orale. Tuttavia, se i pazienti stanno migliorando, tollerano la terapia orale, hanno un tratto gastrointestinale funzionale e hanno un organismo isolato che è sensibile agli antibiotici orali disponibili, il passaggio alla terapia orale può essere fatto. Se non viene isolato alcun organismo, ma un paziente è stato sicuramente ritenuto affetto da NP, gli antibiotici orali selezionati dovrebbero avere lo stesso spettro di attività degli antibiotici IV precedentemente somministrati. In molti casi, i pazienti avranno un’infezione con un organismo che è suscettibile solo agli antibiotici per via endovenosa. Questi pazienti sono probabilmente abbastanza malati per completare un corso completo di una settimana di flebo in ospedale, ma se non hanno una malattia co-morbida attiva e sono migliorati, possono avere una linea PICC (o un altro accesso IV a lungo termine) e ricevere il resto della loro terapia a casa o in un altro ambiente di minore acuità.
In tutti i pazienti che sviluppano NP, le cause reversibili di aspirazione devono essere ricercate, e nei casi in cui vengono isolati organismi multiresistenti, questo deve essere segnalato a qualsiasi struttura in cui il paziente viene trasferito o al medico di base o all’infermiere a domicilio che assumerà la cura dopo la dimissione.
- Linee guida per la gestione degli adulti con polmonite acquisita in ospedale, associata al ventilatore e associata all’assistenza sanitaria. Am J Respir Crit Care Med. 2005;171:388-416.
- Warren DK, Shukla SJ, Olsen MA, et al. Risultato e costo attribuibile della polmonite associata al ventilatore tra i pazienti dell’unità di terapia intensiva in un centro medico suburbano. Crit Care Med. 2003;31:1312-7.
- Flanders SA, Collard HR, Saint S. Prevenire la polmonite nosocomiale. In: Lautenbach E, Woeltje K, eds. The Society for Healthcare Epidemiology of America: Practical Handbook for Healthcare Epidemiologists. Thorofare, NJ: Slack, 2004:69-78.
- Pugin J, Auckenthaler R, Mili N, Janssens JP, Lew PD, Suter PM. Diagnosi di polmonite associata al ventilatore mediante analisi batteriologica del liquido di lavaggio broncoalveolare “cieco” broncoscopico e non broncoscopico. Am Rev Respir Dis. 1991;143:1121-9.
- Singh N, Rogers P, Atwood CW, Wagener MM, Yu VL. Terapia antibiotica empirica di breve durata per i pazienti con infiltrati polmonari nell’unità di terapia intensiva. Una soluzione proposta per la prescrizione indiscriminata di antibiotici. Am J Respir Crit Care Med. 2000;162:505-11.
- Gibot S, Cravoisy A, Levy B, Bene MC, Faure G, Bollaert PE. Recettore di attivazione solubile espresso sulle cellule mieloidi e la diagnosi di polmonite. N Engl J Med. 2004;350:451-8.
- Chastre J, Fagon JY. Polmonite associata al ventilatore. Am J Respir Crit Care Med. 2002;165:867-903.
- Paul M, Benuri-Silbiger I, Soares-Weiser K, Leibovici L. Beta lactam monoterapia versus beta lactam-aminoglicoside combination therapy for sepsis in immunocompetent patients: systematic review and metaanalysis of randomised trials. BMJ. 2004;328:668.
- Chastre J, Wolff M, Fagon JY, et al. Comparazione di 8 vs 15 giorni di terapia antibiotica per la polmonite associata al ventilatore negli adulti: uno studio randomizzato. JAMA. 2003;290:2588-98.
- Dennesen PJ, van der Ven AJ, Kessels AG, Ramsay G, Bonten MJ. Risoluzione dei parametri infettivi dopo la terapia antimicrobica in pazienti con polmonite associata a ventilatore. Am J Respir Crit Care Med. 2001;163:1371-5.
- Collard HR, Saint S, Matthay MA. Prevenzione della polmonite associata al ventilatore: una revisione sistematica basata sull’evidenza. Ann Intern Med. 2003;138:494-501.
- Drakulovic MB, Torres A, Bauer TT, Nicolas JM, Nogue S, Ferrer M. Supine body position as a risk factor for nosocomial pneumonia in mechanically ventilated patients: a randomised trial. Lancet. 1999;354:1851-8.
- Dezfulian C, Shojania K, Collard HR, Kim HM, Matthay MA, Saint S. Drenaggio delle secrezioni sottoglottiche per la prevenzione della polmonite associata al ventilatore: una metanalisi. Am J Med. 2005;118:11-8.
- Dodek P, Keenan S, Cook D, et al. Evidence-based clinical practice guideline for the prevention of ventilator-associated pneumonia. Ann Intern Med. 2004;141:305-13.