Introduction to Chemical Bonding
Lewis diagram for Molecular Compounds/Ions
分子化合物やイオンのルイス図を描くには、以下の手順に従ってください(ここではH2Oを例にしています):
1) 分子化合物やイオンの価電子の数を数えてください。
1)分子化合物またはイオンの価電子の数を数えます。同じ元素が2つ以上ある場合は、価電子の数を原子の数の2倍または4倍にしなければならないことを覚えておいてください。 ローマ数字のグループ番号をたどると、その元素に対応する価電子の数がわかります。
価電子:
酸素(O)–グループVIA:したがって、価電子は6個あります
水素(H)–グループIA:したがって、価電子は1個あります
注意。 水素原子は2個あるので、1価の電子×2個の原子を掛ける
合計:6+2=8価の電子
2)問題の分子がイオンの場合、ステップ1の合計にそれぞれの電子の数を加減することを忘れないでください。
イオンの場合、負の電荷を持つイオン(アニオン)であれば、対応する数の電子を全電子数に加えます(例:NO3-の負の電荷が1であれば、1個余分に電子を加え、5+3(6)=23+1=24個の全電子数となります)。 符号が-の場合は、その分子が全体的に負の電荷を持っていることを意味するので、この余分な電子を持たなければならない。 これは、陰イオンの方が電子親和力(電子を獲得する傾向)が高いためです。
イオンが正の電荷を持つ場合(陽イオン)、対応する電子数を全体の電子数から引きます(例:H3O+は1+の正電荷を持つので、全体の電子数から1個余分に引きます;6 + 1(3) = 9 – 1 = 8 total electrons)。 の記号は、その分子が全体的に正の電荷を持っていることを意味するので、電子が1個足りないはずです。 陽イオンは正で、電子親和力が弱い。 ほとんどが金属で構成されており、その原子半径は非金属よりも大きい。
この例では、水は中性分子であるため、全体から電子を加減する必要はありません。
3) 元素の記号を書き出し、すべての原子が説明されていることを確認します(例:H2Oでは、Oと酸素の両側に2つのHを書き出す)。
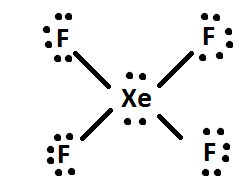
4) 余った電子があれば、それを分子の中心となる原子に加えます(例:XeF4は分配された後に4個の電子が余っているので、4個の余った電子をXeに与える:というように)。

p