Nosocomial Pneumonia
(This chapter has been reprinted with permission from Williams MV, Hayward R: Comprehensive Hospital Medicine, 1st edition. Philadelphia, WB Saunders, in press.)
背景
院内肺炎(Nosocomial pneumonia)は、院内感染で死亡した患者の中で、死亡率の高い原因となっています。 院内肺炎は、入院後48時間以上経過した後に発症した肺炎と定義され、また、人工呼吸開始後48~72時間後に発症した肺炎と定義される人工呼吸器関連肺炎(VAP)も含まれる。 肺炎の発生率は、入院患者1,000人あたり5~15人とされています。 医療関連肺炎(HCAP)は、肺炎の一連の流れの中で、病院外で発症する肺炎の割合がますます増加しています(表I)(1)。 一般的には、老人ホームや介護施設に入所している人が罹患することが多く、これらの患者は抗生物質耐性菌のリスクがあるため、市中肺炎ではなく院内肺炎と同様のアプローチをとるべきである。
肺炎に起因する死亡率については議論がありますが、30%程度になると考えられています。 院内肺炎の存在は、病院の在院日数を平均7~10日増加させ、VAPの場合は、1件あたり10,000~40,000ドルの費用がかかると推定されています(2)。
Assessment
Clinical Presentation
Signs and Symptoms
院内肺炎は通常、臨床的根拠に基づいて診断されます。 典型的な症状と徴候は、発熱、痰を伴う咳、低酸素状態での息切れ、胸部X線写真(CXR)での新たな浸潤である。 高齢者の場合、徴候はより微妙であり、咳がなくてもせん妄、発熱、または白血球増加があれば検討すべきです。 NPの可能性は、微量吸引、口腔咽頭への感染、耐性菌の過剰繁殖などの危険因子を持つ患者で高くなる(表II)(3)。
鑑別診断
NPの診断を確定する前に、発熱、低酸素症、肺浸潤の別の原因を検討すべきである。 最も一般的な原因は、肺塞栓、肺水腫、無気肺などである。
 TABLE II. 院内肺炎のリスクファクター
TABLE II. 院内肺炎のリスクファクタークリックで拡大表示
クリックで拡大表示
診断
院内肺炎の診断戦略は、診断を確定し、病因となる病原体を特定することで、タイムリーで効果的、かつ合理的な抗生物質治療を可能にすることを目指している。 残念ながら、院内肺炎を診断するための最良の方法についてのコンセンサスはありません。 全血球計算と血液培養を行った後、診断のアプローチとして、臨床診断か微生物学的診断かを選択することができます。 臨床診断では、発熱、白血球増加、膿性痰などの感染症の徴候とともに、新規または進行性のX線像による浸潤に依存します。 臨床診断は感度が高いが、抗生物質の使いすぎにつながる可能性が高い。
好ましい研究
微生物学的アプローチによる診断は、定量的または半定量的な培養を用いて、抗生物質治療の閾値を設定することに依存しています。
Bronchoscopic Approaches:
気管支鏡を用いたアプローチ:気管支肺胞洗浄(BAL)のカットオフ値を10(4)個/mLとした場合、または保護された検体ブラシ(PSB)のカットオフ値を10(3)個/mLとした場合、抗生物質の投与を開始する前、またはすでに抗生物質の投与を受けている患者の場合はその変更前に実施することで、最も特異的な診断検査となると考えられる。 臨床的に安定した患者では、細菌の増殖が基準値以下になれば、安全に抗生物質の投与を中止することができる。 培養が陽性の場合は、同定された生物を標的として抗生物質治療を行うべきである。 気管支鏡によるアプローチは、機械的に人工呼吸を行っている患者、入院期間の後半(>5~7日)に肺炎を発症した患者、異常な病原体のリスクがある患者、治療に失敗した患者、別の診断が疑われる患者に好まれる。
非気管支鏡的アプローチ:気管内吸引(ETA)は、人工呼吸患者において非常に感度が高く、後にBALやPSBで発見される可能性のある生物を定期的に特定し、陰性であれば抗生物質の投与を控えるべきであることが示されている。 抗生物質の過剰使用を減らすために、10(6)個/mLのカットオフ値を設定した定量的気管内吸引が推奨されることが多いが、感度と特異度が約75%しかないため、結果を慎重に解釈する必要がある(1)。 定量的ETAが陰性の臨床的に安定した患者でも、過去72時間に抗生物質が変更されていなければ、抗生物質の投与を控えることを考慮すべきである。 多くのICUでは、吸引カテーテルを用いた下気道分泌物のブラインドサンプリング(ブラインドPSB、ブラインドミニBAL)を実施し始めている。 これらの技術は、訓練を受けた呼吸療法士や看護師が四六時中行うことができ、気管支鏡検査と同様の培養データが得られ、気管支鏡検査よりも安全でコストがかからない可能性がある。 一般的に、機械的に換気されていない患者では、気管支鏡を使わない方法が望ましい。 痰の採取は容易であるが、NPではあまり研究されていない。 しかし、気管支鏡やその他の非気管支鏡的手法が不可能な患者では、潜在的な耐性菌を特定し、治療法を調整するために喀痰吸引を行うことができる。
代替案
Clinical Pulmonary Infection Scor-Combining Clinical and Microbiologic Approaches
院内肺炎の臨床診断(新しい浸潤+発熱、白血球増加、または膿性痰)は、おそらく抗生物質の過剰使用につながりますが、気管支鏡診断を追求することは侵襲的でコストがかかり、専門知識が必要です。 上述の定量的ETA、ブラインドPSB、ブラインドBALは、気管支鏡検査の必要性を回避しつつ、抗生物質の過剰使用を防ぐために微生物学的データを追加するいくつかの妥協案の例である。 また、臨床+微生物学的診断を組み合わせた診断方法も有効である。 そのような選択肢の一つとして、臨床的肺感染スコア(CPIS)の使用がある。CPISは、臨床的、X線的、生理学的、および微生物学的データを組み合わせて数値化したものである。 スコア>6は、定量的BALとよく相関することが示されている(4)。 しかし、最近の研究では、抗生物質の過剰使用につながる可能性のある低い特異性が示唆されているが、このアプローチは一般的な臨床的アプローチよりも正確である。 NPが疑われた時点でCPISを連続的に使用し、72時間後に再度使用することがより有用である。 最初に肺炎の臨床的疑いが低い(CPISが6以下)患者でも、CPISが低いままであれば、72時間後に安全に抗生物質を中止することができる(5)。
感染症の生物学的マーカーに関する複数の研究では、肺炎が疑われる場合に抗生物質の投与が必要な人を非侵襲的に、迅速かつ正確に判断する方法を見つけようとしてきました。 残念ながら、その結果はほとんど期待外れであった。 最近では、感染時に上昇する骨髄系細胞に発現する可溶性のトリガー受容体(sTREM-1)を測定することで、NPを正確に診断する能力が向上することが示された。 機械的に人工呼吸を行っている患者の肺炎の診断において、sTREM-1の測定は感度98%、特異度90%でした(6)。
管理
初期治療
適切な経験的抗生物質療法(すなわち、投与された抗生物質が分離されたすべての生物に対して有効であることが示されている)を早期に開始することは、初期の不十分な治療と比較して、生存率の向上と関連しています(1,7)。 抗生物質は、血液や喀痰を採取して培養した後、直ちに投与を開始すべきであり、診断検査が遅れた場合にも投与を控えるべきではない。 抗生物質を迅速に選択する必要性から、広域スペクトルの抗生物質が使用される。 広域抗生物質の不必要な過剰使用を避けるためには、多剤耐性(MDR)病原体のリスクに基づいて治療を行うべきである。 MDR病原体のリスクが低い患者を臨床的な基準で特定することで、より狭い範囲で、しかし効果的な抗生物質治療が可能となる。 低リスクの患者とは、入院早期(<5~7日)に肺炎を発症し、免疫不全ではなく、広域抗生物質の投与歴がなく、HCAPの危険因子を持たない患者である(表I)(1,7)。 これらの患者では、抗生物質は一般的な市中感染菌を対象とすべきである(表III-低リスク病原体)。 適切な初期抗生物質療法には、第三世代セファロスポリンまたはβ-ラクタム/β-ラクタマーゼ阻害剤が含まれる。
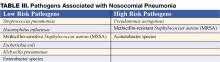 click for large version
click for large version
click for large version
残念なことに、複雑化する今日の入院患者は、特に集中治療室では「低リスク」である可能性は低い。
ローリスクの基準を満たさない患者は、MDR病原体に対してハイリスクであると考えられる(表III-ハイリスク病原体)。 初期の経験的治療は幅広く行う必要があり、1種類の抗偽菌薬(セフェピムまたはイミペネムまたはβ-ラクタム/β-ラクタマーゼ阻害薬)+フルオロキノロンまたはアミノグリコシド+バンコマイシンまたはリネゾリドを含むべきである。 初期の経験的治療法は、地域の耐性パターン、コスト、および好ましい薬剤の入手可能性によって決定されるべきである。 このような広範囲の治療を開始する場合、抗生物質の過剰使用を抑えるために、抗生物質を「デ・エスカレーション」することが必須となる。 De-escalation療法は、培養結果に基づいて抗生物質の範囲を狭め、全体の治療期間を制限することに重点を置いている。
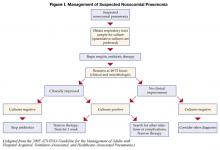 図I. 院内肺炎が疑われる場合の管理
図I. 院内肺炎が疑われる場合の管理クリックで拡大表示
クリックで拡大表示
その後の治療
院内肺炎が疑われ、初回のエンピリック抗生物質療法を開始した患者は、48~72時間後に再評価する必要がある。 具体的には、培養を確認し、治療に対する臨床反応を評価する必要がある。 図Iは、治療の指針となるアルゴリズムを示したものである(1)。 臨床的に安定しており、下気道の培養が陰性の患者では、抗生物質の投与を中止することができる。 培養が陽性の患者では、同定された菌に基づいて抗生物質を調整するか、または「デエスカレート」する必要がある。 一般的には、分離された細菌に有効な最も狭いスペクトルの抗生物質を使用すべきである。 グラム陰性菌に対する併用療法(分離された細菌に有効な2種類以上の抗生物質)は、相乗効果を得るため、あるいは耐性の発生を防ぐために広く行われている。 しかし、好中球減少がない場合、併用療法が単剤療法に比べて優れていることは示されておらず(8)、単剤療法が望ましいとされています。 また、呼吸器検体からMRSAが分離された場合にも、単剤療法を行うべきである。
de-escalationの第二の要素は、治療期間の短縮です。 CPISは、肺炎のリスクが低い患者の治療期間を短縮するために使用できるかもしれません。 退役軍人援護局の医療センターの研究者らは、NPの疑いがあり、CPISスコア< 6の患者を、10〜21日間の治療、またはショートコース療法のいずれかに無作為に割り付けた。 ショートコース療法を受けた患者は、3日目に再評価され、CPISスコアが< 6のままであれば、抗生物質の投与を中止した(5)。 ショートコース療法群は、標準治療群と比較して死亡率に差はなかったが、抗生物質の使用量が少なく、ICUの滞在期間が短く、超感染や耐性菌による感染症を発症する可能性が低かった。 CPISを使用しない場合や、患者のリスクが高いと感じられる場合、あるいはNPがあることが説得力をもって証明された場合には、やはりより短期間の治療コースが望ましいと思われる。 大規模な無作為化試験では、VAP患者に8日間の抗生物質治療を行った場合、15日間の治療と比較して同等の臨床結果が得られることが示された。 さらに、短期間の抗生物質治療は、多剤耐性病原体による後続の感染症を発症する可能性が低いことと関連していた。 非発酵性グラム陰性菌(緑膿菌など)に感染した8日間の治療群の一部の患者では、肺感染症の再発率が高かったが、積極的なサーベイランスにより、この一部の患者の死亡リスクが高くなることはなかった(9)。
まとめとして、肺炎が疑われる患者の治療は、直ちに抗生物質の投与を開始し、呼吸器の分泌物を採取することから始まります。 低リスクの患者にはより狭いスペクトルの治療が可能であるが、ほとんどの患者には広範囲の初期経験的治療が必要である。 しかし、患者が改善している場合は、微生物学的な結果に基づいて、48~72時間後に抗生物質レジメンを絞る必要がある。 全体的な治療期間は1週間程度が安全で効果的であり、耐性菌の増殖を促進する可能性は低い。
予後
NPに対する治療が開始されると、通常48~72時間で臨床的な改善が見られます。 微生物学的な反応(培養液の陽性反応の消失)や胸部X線写真による反応を追跡することはほとんど支持されていない。 胸部X線写真は臨床反応に遅れることが多いが、最初の48時間以内にCXRが著しく悪化した場合(>浸潤が50%増加した場合)は、治療の失敗を意味することがある。 体温、白血球数、酸素濃度で測定される臨床的な解決は、通常6~7日までに起こります(10)。
NP患者の全体的な死亡率は30〜70%と高く、これは主に、リスクのある集団における重度の併存疾患によるものです。
NP患者の全体的な死亡率は30~70%と高く、主な原因は重度の併存疾患です。
予防
予防戦略は、入院患者の感染性合併症の全体的な発生率を低下させることを目的としたものと、院内肺炎の発生率を特に低下させることを目的としたものがあります(3)。 予防戦略を裏付けるデータの大半は、ICUに入院している患者、特に人工呼吸を受けている患者に限られています。 しかし、予防策の多くは、ICU以外の患者にも適用できるものである。
一般的な予防策
一般的な予防策は、病院内に存在する抗菌薬耐性菌による患者の汚染を回避すること、またはそもそも抗菌薬耐性菌の出現を緩和することを目的としています。 耐性菌の異時的な拡散を防ぐには、丁寧な手指衛生が重要です。 患者との接触の前後に手を洗うことで、院内感染の発生率を下げることができます。 ベッドサイドに置かれたアルコールベースのハンドリンスは、実際には石鹸や水よりも優れている可能性があり、さらに手指衛生のコンプライアンスを向上させます。
留置器具(セントラルライン、尿道カテーテル)の使用を最小限に抑えることも、耐性菌の出現を抑えます。 これらの器具が必要な場合は、タイムリーに除去することが重要です。 抗生物質の使用をコントロールすることは、多くの予防戦略の中心となっている。 広域抗生物質の長期使用や不必要な使用は、耐性菌の発生やコロニー形成に強く関連している。 積極的に抗生物質の使用を控える戦略(前述)は、重要な予防手段である。 一部の施設では抗生物質の制限やローテーションに成功していますが、これらの手法の有効性に関する長期的なデータは不足しています。
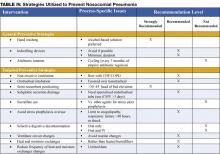 クリックで拡大表示
クリックで拡大表示
クリックで拡大表示
ターゲットを絞った予防戦略
div
NPの発生率を低下させる予防戦略は、中咽頭または胃のコロニー形成と、それに続く汚染された中咽頭または胃の分泌物の吸引の危険因子を減らすことに焦点を当てています(1,3,7,11).
気管内挿管は、人工呼吸を必要とする患者におけるNPの最も重要なリスク要因の1つです。 特定の患者グループに非侵襲的換気(NIV)または陽圧マスク換気を使用することは、院内肺炎の予防に効果的です。 非侵襲的換気は、慢性閉塞性肺疾患(COPD)の急性増悪やうっ血性心不全(CHF)に起因する肺水腫の患者で最も効果を発揮しており、適切に選択された患者で検討されるべきです。
仰向けの姿勢は、胃液の逆流とそれに伴う誤嚥のリスクを高めるため、気管支喘息の発症につながる可能性があります。 半側臥位(ベッドの頭を>45度上げた状態)の研究では、胃液の逆流や誤嚥が少なく、最近の無作為化比較試験ではVAPの発生率が有意に減少したことが示されている(12)。
声門下分泌物のドレナージ(SSD)は、専用の気管内チューブのカフの上に溜まった分泌物を除去するもので、そうしないと肺に漏れる可能性があります。 この新しい技術を評価した5つの研究のメタアナリシスでは、VAPの発生率が有意に減少したことが示されています。
H2拮抗薬や制酸剤など、胃のpHを上昇させるストレス性潰瘍予防に使用される薬は、病原性を持つ可能性のある生物による上部消化管のコロニー形成を可能にするため、NPのリスクを高めることになります。 H2拮抗薬の代わりにスクラルファートを使用することで、胃のアルカリ化が抑えられ、細菌の増殖が抑えられると考えられている。 しかし、スクラルファートの院内肺炎予防効果は十分に証明されておらず、日常的な使用は推奨されていない(14)。 むしろ、ストレス潰瘍予防薬の使用を、臨床的に重大な出血のリスクが高い人々、すなわち、凝固障害や長期の人工呼吸器不全のある患者に限定する努力をすべきである。 ICUにいないほとんどの患者はストレス潰瘍予防を受けるべきではない。
選択的消化器系除染(Selective digestive decontamination: SDD)は、機械的に人工呼吸を行っている患者の中咽頭と消化管を除菌することで、病原性のある細菌を大量に吸引し、その後のVAPを防ぐことを目的としています。 SDDのほとんどの評価では、ポリミキシン、アミノグリコシド、アンフォテリシンの外用薬を経口(時には胃)で使用している。 多くの場合、短期間の抗生物質の静脈内投与が追加されている。 少なくとも10のメタアナリシスで、SDDの使用によるVAPのリスクの減少が示されている。 また、抗生物質の静脈内投与を追加することで、死亡率の改善も期待できる。
人工呼吸器の回路、フィルター、チューブ内の汚染物質の吸引を減らすために、いくつかの予防策があります。 推奨される戦略は、16ページの表IIIに記載されていますが、ルーチンの人工呼吸器回路の交換を避けること(目に見えて汚染されている場合や新しい患者の場合にのみチューブを交換する)、加熱式加湿器ではなく熱交換器や水分交換器を使用すること、熱交換器や水分交換器の交換頻度を減らすことなどが挙げられます(1,11,14)。
退院/フォローアッププラン
患者は、治療に反応して臨床的に改善していることが明らかになるまで、病院でフォローする必要があります。 患者を迅速に経口治療に移行させる戦略の評価は限られていました。 しかし、患者が改善しており、経口治療に耐えられ、胃腸管が機能していて、経口抗生物質に感受性のある菌が分離された場合は、経口治療に移行することができます。 有機体は分離されなかったが、患者が確実にNPに罹患していると思われる場合、経口抗生物質は、以前に投与された静脈内抗生物質と同じスペクトルの活性を持つものを選択すべきである。 多くの場合、患者は静脈内投与の抗生物質にしか感受性を示さない生物に感染している。 このような患者は、病院で1週間の静脈内投与を完了するのに十分な病状である可能性が高いですが、活動性のある併存疾患がなく、症状が改善している場合には、PICCライン(または他の長期的な静脈内アクセス)を設置し、自宅または他の低視力の環境で残りの治療を受けることができます。
NPを発症したすべての患者において、可逆的な誤嚥の原因を探り、多剤耐性菌が分離された場合は、患者が転院する施設や退院後のケアを担当する主治医や訪問看護師に報告しなければなりません。 Am J Respir Crit Care Med. 2005;171:388-416.
。