De Nobelprijs Het Nobelprijslogo
Engels
Engels (pdf)
Zweeds
![]()
De Nobel Assembly van het Karolinska Institutet heeft vandaag besloten om
de Nobelprijs voor fysiologie of geneeskunde 2016
toe te kennen aan
Yoshinori Ohsumi
voor zijn ontdekkingen van mechanismen voor autofagie
Samenvatting
De Nobelprijswinnaar van dit jaar ontdekte en verhelderde mechanismen die ten grondslag liggen aan autofagie, een fundamenteel proces voor de afbraak en recycling van cellulaire componenten.
Het woord autofagie is afgeleid van de Griekse woorden auto-, dat “zelf” betekent, en phagein, dat “eten” betekent. Autofagie betekent dus “zelf eten”. Dit concept ontstond in de jaren 1960, toen onderzoekers voor het eerst waarnamen dat de cel zijn eigen inhoud kon vernietigen door deze in te sluiten in membranen, waarbij zakvormige blaasjes werden gevormd die werden getransporteerd naar een recyclerend compartiment, het lysosoom genaamd, voor afbraak. Door moeilijkheden bij het bestuderen van het fenomeen was er weinig bekend, totdat Yoshinori Ohsumi in een reeks briljante experimenten in het begin van de jaren negentig bakkersgist gebruikte om genen te identificeren die essentieel zijn voor autofagie. Vervolgens legde hij de onderliggende mechanismen voor autofagie in gist bloot en toonde aan dat in onze cellen een soortgelijke geavanceerde machinerie wordt gebruikt.
Ohsumi’s ontdekkingen leidden tot een nieuw paradigma in ons begrip van hoe de cel zijn inhoud recyclet. Zijn ontdekkingen openden de weg naar begrip van het fundamentele belang van autofagie in veel fysiologische processen, zoals bij de aanpassing aan verhongering of de reactie op infectie. Mutaties in autofagiegenen kunnen ziekten veroorzaken, en het autofagieproces is betrokken bij verschillende aandoeningen, waaronder kanker en neurologische aandoeningen.
Afbraak – een centrale functie in alle levende cellen
In het midden van de jaren vijftig namen wetenschappers een nieuw gespecialiseerd celcompartiment waar, een organel genaamd, dat enzymen bevat die eiwitten, koolhydraten en vetten verteren. Dit gespecialiseerde compartiment wordt een “lysosoom” genoemd en functioneert als een werkstation voor de afbraak van cellulaire bestanddelen. De Belgische wetenschapper Christian de Duve kreeg de Nobelprijs voor Fysiologie of Geneeskunde in 1974 voor de ontdekking van het lysosoom. Nieuwe waarnemingen in de jaren zestig toonden aan dat grote hoeveelheden cellulaire inhoud, en zelfs hele organellen, soms binnenin lysosomen konden worden aangetroffen. De cel bleek dus over een strategie te beschikken om grote ladingen in het lysosoom af te leveren. Verdere biochemische en microscopische analyse bracht een nieuw type blaasje aan het licht dat cellulaire lading naar het lysosoom transporteert voor afbraak (figuur 1). Christian de Duve, de wetenschapper achter de ontdekking van het lysosoom, bedacht de term autofagie, “zelf-eten”, om dit proces te beschrijven. De nieuwe blaasjes kregen de naam autofagosomen.
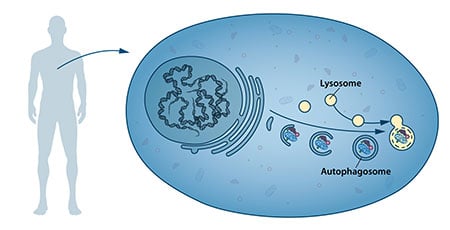
Tijdens de jaren zeventig en tachtig richtten onderzoekers zich op de opheldering van een ander systeem dat wordt gebruikt om eiwitten af te breken, namelijk het “proteasoom”. Binnen dit onderzoeksgebied kregen Aaron Ciechanover, Avram Hershko en Irwin Rose de Nobelprijs voor de scheikunde van 2004 voor “de ontdekking van ubiquitine-gemedieerde eiwitafbraak”. Het proteasoom breekt efficiënt eiwitten één voor één af, maar dit mechanisme verklaarde niet hoe de cel zich ontdoet van grotere eiwitcomplexen en versleten organellen. Zou het proces van autofagie het antwoord kunnen zijn, en zo ja, wat waren de mechanismen?
Een baanbrekend experiment
Yoshinori Ohsumi was actief geweest op verschillende onderzoeksterreinen, maar toen hij in 1988 zijn eigen lab begon, richtte hij zijn inspanningen op eiwitafbraak in de vacuole, een organel die overeenkomt met het lysosoom in menselijke cellen. Gistcellen zijn relatief gemakkelijk te bestuderen en worden dan ook vaak gebruikt als model voor menselijke cellen. Zij zijn bijzonder nuttig voor de identificatie van genen die belangrijk zijn in complexe cellulaire trajecten. Maar Ohsumi stond voor een grote uitdaging; gistcellen zijn klein en hun inwendige structuren zijn niet gemakkelijk te onderscheiden onder de microscoop en dus wist hij niet zeker of autofagie zelfs wel bestond in dit organisme. Ohsumi redeneerde dat als hij het afbraakproces in de vacuole kon verstoren terwijl het autofagieproces actief was, dan zouden autofagosomen zich moeten ophopen in de vacuole en zichtbaar worden onder de microscoop. Hij kweekte daarom gemuteerde gist zonder vacuolaire afbraakenzymen en stimuleerde tegelijkertijd autofagie door de cellen uit te hongeren. De resultaten waren opvallend! Binnen enkele uren waren de vacuolen gevuld met kleine blaasjes die niet waren afgebroken (figuur 2). De blaasjes waren autofagosomen en Ohsumi’s experiment bewees dat autofagie bestaat in gistcellen. Maar wat nog belangrijker was, was dat hij nu een methode had om de belangrijkste genen die bij dit proces betrokken zijn, te identificeren en te karakteriseren. Dit was een belangrijke doorbraak en Ohsumi publiceerde de resultaten in 1992.

Autofagiegenen ontdekt
Ohsumi maakte nu gebruik van zijn gemanipuleerde giststammen waarin autofagosomen zich ophoopten tijdens verhongering. Deze ophoping zou niet mogen optreden als genen die belangrijk zijn voor autofagie waren geïnactiveerd. Ohsumi stelde de gistcellen bloot aan een chemische stof die willekeurig mutaties in veel genen introduceerde, en vervolgens induceerde hij autofagie. Zijn strategie werkte! Binnen een jaar na zijn ontdekking van autofagie in gist, had Ohsumi de eerste genen geïdentificeerd die essentieel zijn voor autofagie. In zijn daaropvolgende reeks elegante studies werden de eiwitten die door deze genen werden gecodeerd functioneel gekarakteriseerd. De resultaten toonden aan dat autofagie wordt gecontroleerd door een cascade van eiwitten en eiwitcomplexen, die elk een afzonderlijke fase van autofagosoom-initiatie en -vorming reguleren (figuur 3).
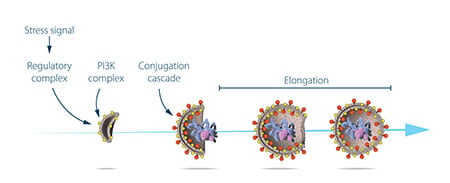
Autofagie – een essentieel mechanisme in onze cellen
Nadat de machinerie voor autofagie in gist was geïdentificeerd, bleef er nog een belangrijke vraag over. Was er een overeenkomstig mechanisme om dit proces in andere organismen te controleren? Al snel werd duidelijk dat in onze eigen cellen vrijwel identieke mechanismen werkzaam zijn. De onderzoeksinstrumenten die nodig waren om het belang van autofagie bij mensen te onderzoeken, waren nu beschikbaar.
Dankzij Ohsumi en anderen die in zijn voetsporen traden, weten we nu dat autofagie belangrijke fysiologische functies regelt waarbij cellulaire componenten moeten worden afgebroken en gerecycled. Autofagie kan snel brandstof leveren voor energie en bouwstenen voor vernieuwing van cellulaire componenten, en is daarom essentieel voor de cellulaire reactie op verhongering en andere vormen van stress. Na infectie kan autofagie binnendringende intracellulaire bacteriën en virussen elimineren. Autofagie draagt bij tot de ontwikkeling van embryo’s en de differentiatie van cellen. Cellen gebruiken autofagie ook om beschadigde eiwitten en organellen te elimineren, een kwaliteitscontrolemechanisme dat van cruciaal belang is voor het tegengaan van de negatieve gevolgen van veroudering.
Ongestoorde autofagie is in verband gebracht met de ziekte van Parkinson, diabetes type 2 en andere aandoeningen die bij ouderen optreden. Mutaties in autofagiegenen kunnen genetische ziekten veroorzaken. Stoornissen in de autofagische machinerie zijn ook in verband gebracht met kanker. Er wordt nu intensief onderzoek gedaan naar de ontwikkeling van geneesmiddelen die zich bij verschillende ziekten kunnen richten op autofagie.
Autofagie is al meer dan 50 jaar bekend, maar het fundamentele belang ervan voor de fysiologie en de geneeskunde werd pas erkend na het paradigmaverschuivende onderzoek van Yoshinori Ohsumi in de jaren negentig van de vorige eeuw. Voor zijn ontdekkingen krijgt hij dit jaar de Nobelprijs voor fysiologie of geneeskunde.
Key publications
Takeshige, K., Baba, M., Tsuboi, S., Noda, T. and Ohsumi, Y. (1992). Autofagie in gist aangetoond met proteïnase-deficiënte mutanten en voorwaarden voor de inductie ervan. Journal of Cell Biology 119, 301-311
Tsukada, M. and Ohsumi, Y. (1993). Isolatie en karakterisering van autofagie-defecte mutanten van Saccharomyces cervisiae. FEBS Letters 333, 169-174
Mizushima, N., Noda, T., Yoshimori, T., Tanaka, Y., Ishii, T., George, M.D., Klionsky, D.J., Ohsumi, M. and Ohsumi, Y. (1998). Een eiwit conjugatie systeem essentieel voor autofagie. Nature 395, 395-398
Ichimura, Y., Kirisako T., Takao, T., Satomi, Y., Shimonishi, Y., Ishihara, N., Mizushima, N., Tanida, I., Kominami, E., Ohsumi, M., Noda, T. and Ohsumi, Y. (2000). Een ubiquitine-achtig systeem medieert eiwitlipidatie. Nature, 408, 488-492
Yoshinori Ohsumi werd in 1945 geboren in Fukuoka, Japan. Hij promoveerde aan de Universiteit van Tokio in 1974. Na een verblijf van drie jaar aan de Rockefeller University in New York, VS, keerde hij terug naar de Universiteit van Tokio waar hij in 1988 zijn onderzoeksgroep oprichtte. Sinds 2009 is hij hoogleraar aan het Tokyo Institute of Technology.
De Nobelvergadering, bestaande uit 50 hoogleraren van het Karolinska Institutet, kent de Nobelprijs voor Fysiologie of Geneeskunde toe. Het Nobelcomité beoordeelt de voordrachten. Sinds 1901 wordt de Nobelprijs toegekend aan wetenschappers die de belangrijkste ontdekkingen ten bate van de mensheid hebben gedaan.
Nobel Prize® is het geregistreerde handelsmerk van de Nobel Stichting