Introductie tot chemische binding
Lewis-diagrammen voor moleculaire verbindingen/ionen
Om de lewis-diagrammen voor moleculaire verbindingen of ionen te tekenen, volg je de onderstaande stappen (we gebruiken H2O als voorbeeld):
1) Tel het aantal valantie-elektronen van de moleculaire verbinding of het ion. Denk eraan, als er twee of meer van hetzelfde element zijn, dan moet je het aantal valantie-elektronen verdubbelen of vermenigvuldigen met het aantal atomen dat er zijn. Volg het Romeinse groepsnummer om te zien hoeveel valantie-elektronen er voor dat element zijn.
Valantie-elektronen:
Zuurstof (O)–Groep VIA: er zijn dus 6 valantie-elektronen
Hydrogeen (H)–Groep IA: er is dus 1 valantie-elektron
Aantekening: Er zijn TWEE waterstofatomen, dus vermenigvuldig 1 valantie-elektron X 2 atomen
Totaal: 6 + 2 = 8 valantie-elektronen
2) Als het molecuul in kwestie een ion is, denk er dan aan om het respectieve aantal elektronen bij het totaal van stap 1 op te tellen of af te trekken.
Voor ionen, als het ion een negatieve lading heeft (anion), tel je het overeenkomstige aantal elektronen op bij het totaal aantal elektronen (d.w.z. als NO3- een negatieve lading heeft van 1-, dan tel je 1 extra elektron op bij het totaal; 5 + 3(6)= 23 +1 = 24 totaal elektronen). Een – teken betekent dat het molecuul een totale negatieve lading heeft, dus moet het dit extra elektron hebben. Dit komt omdat anionen een hogere elektronenaffiniteit hebben (de neiging om elektronen te winnen). De meeste anionen bestaan uit niet-metalen, die een hoge elektronegativiteit hebben.
Als het ion een positieve lading heeft (kation), trek je het overeenkomstige aantal elektronen af van het totale aantal elektronen (d.w.z. H3O+ heeft een positieve lading van 1+, dus trek je 1 extra elektron af van het totaal; 6 + 1(3) = 9 – 1 = 8 totale elektronen). Een + teken betekent dat het molecuul een totale positieve lading heeft, dus moet het een elektron missen. Kationen zijn positief en hebben een zwakkere elektronenaffiniteit. Zij bestaan meestal uit metalen; hun atomaire stralen zijn groter dan de niet-metalen. Dit betekent dat de afscherming groter is, en dat elektronen minder de neiging hebben om te worden aangetrokken door de “afgeschermde” kern.
In ons voorbeeld is water een neutraal molecuul, en daarom hoeven er geen elektronen te worden toegevoegd of afgetrokken van het totaal.
3) Schrijf de symbolen van de elementen op, en zorg ervoor dat alle atomen worden geteld (d.w.z. H2O, schrijf O op en 2 H’s aan weerszijden van de zuurstof). Begin met het toevoegen van enkelvoudige bindingen (1 elektronenpaar) aan alle mogelijke atomen, waarbij je ervoor zorgt dat ze de octet-regel volgen (met uitzondering van de duet-regel en andere elementen die hierboven zijn genoemd).
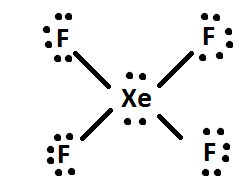
4) Als er nog elektronen over zijn, voeg die dan toe aan het centrale atoom van het molecuul (bijv. XeF4 heeft 4 extra elektronen na te zijn verdeeld, dus de 4 extra elektronen worden aan Xe gegeven: zoals dit. Herschik tenslotte de elektronenparen in dubbele of drievoudige bindingen indien mogelijk.