Nosocomiale pneumonie
(Dit hoofdstuk is met toestemming overgenomen uit Williams MV, Hayward R: Comprehensive Hospital Medicine, 1st edition. Philadelphia, WB Saunders, in press.)
Achtergronden
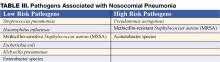
Nosocomiale pneumonie (NP) is de belangrijkste oorzaak van sterfte onder patiënten die overlijden als gevolg van ziekenhuisinfecties. NP wordt gedefinieerd als longontsteking die 48 uur of langer na ziekenhuisopname optreedt, en omvat ook de subset van ventilatiegeassocieerde longontsteking (VAP), gedefinieerd als longontsteking die 48 tot 72 uur na het begin van mechanische beademing ontstaat. De incidentie van NP ligt tussen 5 en 15 gevallen per 1000 ziekenhuisopnames. Aan de gezondheidszorg gerelateerde pneumonie (HCAP), onderdeel van het continuüm van NP, beschrijft een steeds vaker voorkomend deel van de pneumonie dat zich buiten het ziekenhuis ontwikkelt (tabel I) (1). Deze patiënten, die meestal worden getroffen door mensen in een verpleeghuis of een instelling voor begeleid wonen, lopen het risico op antibioticaresistente organismen en moeten op dezelfde manier worden benaderd als gevallen van nosocomiale longontsteking in plaats van door de gemeenschap veroorzaakte longontsteking. De meeste gegevens die onze diagnostische en behandelingsbeslissingen over NP onderbouwen, zijn afkomstig van studies uitgevoerd bij mechanisch beademde patiënten en worden geëxtrapoleerd om aanbevelingen te doen voor niet-beademde patiënten.
Het sterftecijfer dat aan NP kan worden toegeschreven, is omstreden, maar kan oplopen tot 30%. De aanwezigheid van nosocomiale pneumonie verlengt de verblijfsduur in het ziekenhuis met gemiddeld 7-10 dagen, en kost in het geval van VAP naar schatting tussen de $10.000 en $40.000 per geval (2).
Beoordeling
Klinische presentatie
Tekenen en symptomen
Nosocomiale pneumonie wordt meestal gediagnosticeerd op basis van klinische gronden. Typische symptomen en verschijnselen zijn koorts, hoesten met sputum en kortademigheid in combinatie met hypoxie en een nieuw infiltraat op de röntgenfoto van de borstkas (CXR). Bij ouderen kunnen de verschijnselen subtieler zijn en moeten delirium, koorts of leukocytose bij afwezigheid van hoest worden overwogen. De kans op NP neemt toe bij patiënten met risicofactoren voor microaspiratie, orofaryngeale kolonisatie of overgroei van resistente organismen (tabel II) (3).
Differentiële diagnose
Voordat de diagnose NP wordt gesteld, moeten alternatieve oorzaken van koorts, hypoxie en pulmonale infiltraten worden overwogen. Meestal zijn dat longembolus, longoedeem of atelectase. Alternatieve infectiebronnen, zoals urineweginfecties, huid- en weke deleninfecties en apparaatgerelateerde infecties (d.w.z. centrale veneuze katheters) komen vaak voor bij gehospitaliseerde patiënten en moeten worden uitgesloten voordat de diagnose nosocomiale pneumonie wordt gesteld.
 klik voor grote versie
klik voor grote versie
klik voor grote versie
Diagnose
Diagnostische strategieën voor NP zijn erop gericht de diagnose te bevestigen en een etiologisch pathogeen te identificeren, zodat een tijdige, effectieve en gestroomlijnde antibioticatherapie mogelijk is. Helaas bestaat er geen consensus over de beste aanpak voor de diagnose van nosocomiale pneumonie. Na het verkrijgen van een volledig bloedbeeld en bloedkweken, kunt u kiezen tussen een klinische of een microbiologische benadering van de diagnose. Een klinische diagnose berust op een nieuw of progressief radiografisch infiltraat samen met tekenen van infectie zoals koorts, leukocytose, of purulent sputum. De klinische diagnose is gevoelig, maar leidt waarschijnlijk tot overmatig gebruik van antibiotica. De microbiologische benadering vereist bemonstering van afscheidingen van de luchtwegen en kan het ongepaste antibioticagebruik verminderen, maar duurt langer en is mogelijk niet in alle ziekenhuizen beschikbaar.
Voorkeurstudies
De microbiologische benadering van de diagnose berust op het gebruik van kwantitatieve of semi-kwantitatieve kweken om drempels voor antibioticabehandeling vast te stellen. Bacteriële kweken met een groeiniveau boven de hieronder beschreven drempels rechtvaardigen behandeling, terwijl kweken met een groeiniveau onder de drempels moeten leiden tot het achterhouden of staken van antibiotica.
Bronchoscopische benaderingen: Bronchoalveolaire lavage (BAL) met een cutoff van 10 (4) organismen/mL of Protected Specimen Brush (PSB) met een cutoff van 10 (3) organismen/mL worden beschouwd als de meest specifieke diagnostische tests wanneer zij worden uitgevoerd vóór het starten van antibiotica, of vóór het veranderen van antibiotica als een patiënt deze reeds krijgt. Bij klinisch stabiele patiënten kunnen antibiotica veilig worden gestaakt als de bacteriegroei onder de drempelwaarden daalt. Indien de kweken positief zijn, moet de antibioticatherapie worden afgestemd op het geïdentificeerde organisme. De bronchoscopische benadering verdient de voorkeur bij patiënten die mechanisch worden beademd, hun pneumonie laat in het ziekenhuis ontwikkelen (>5-7 dagen), risico lopen op ongebruikelijke pathogenen, therapie faalt of ervan verdacht wordt een alternatieve diagnose te hebben.
Niet-bronchoscopische benaderingen: Van kwalitatieve endotracheale aspiraten (ETA) is aangetoond dat ze bij beademde patiënten vrij gevoelig zijn, regelmatig organismen identificeren die vervolgens met BAL of PSB kunnen worden gevonden, en indien negatief, zouden moeten leiden tot het achterwege laten van antibiotica. Kwantitatieve endotracheale aspiraten met een cutoff van 10 (6) organismen/mL worden vaak aangemoedigd om overmatig antibioticagebruik te verminderen, maar de resultaten moeten voorzichtig worden geïnterpreteerd aangezien zij slechts een sensitiviteit en specificiteit van ongeveer 75% hebben (1). Overwogen moet worden om antibiotica te onthouden bij een klinisch stabiele patiënt met een negatieve kwantitatieve ETA als de antibiotica in de voorafgaande 72 uur niet zijn gewijzigd. Veel IC’s zijn begonnen met het blind afnemen van afscheidingen van de onderste luchtwegen met afzuigkatheters (blinde PSB, blinde mini-BAL). Deze technieken kunnen op alle uren van de dag worden uitgevoerd door opgeleide ademhalingstherapeuten of verpleegkundigen, leveren kweekgegevens op die vergelijkbaar zijn met die van bronchoscopie, en kunnen veiliger en minder kostbaar zijn dan bronchoscopie. In het algemeen wordt de voorkeur gegeven aan niet-bronchoscopische technieken bij patiënten die niet mechanisch worden beademd. Sputum sampling, hoewel gemakkelijk te verkrijgen, is niet goed onderzocht bij NP. Echter, bij patiënten bij wie bronchoscopische of andere niet-bronchoscopische technieken niet haalbaar zijn, kan sputum sampling worden uitgevoerd om potentieel resistente organismen te identificeren en te helpen bij het aanpassen van de therapie.
Alternatieve opties
Clinical Pulmonary Infection Score-Combining Clinical and Microbiologic Approaches
De klinische diagnose van nosocomiale pneumonie (nieuw infiltraat + koorts, leukocytose, of purulent sputum) leidt waarschijnlijk tot overmatig antibioticagebruik, maar het nastreven van een bronchoscopische diagnose is invasief, kostbaar, en vereist technische expertise. De hierboven besproken kwantitatieve ETA, blinde PSB en blinde BAL zijn voorbeelden van enkele compromissen die de noodzaak van bronchoscopie vermijden, maar microbiologische gegevens toevoegen in een poging overmatige antibiotische therapie te voorkomen. Het formeel combineren van diagnostische benaderingen (klinisch + microbiologisch) kan ook nuttig zijn. Een van deze opties is het gebruik van de klinische pulmonale infectiescore (CPIS), die klinische, radiografische, fysiologische en microbiologische gegevens combineert tot een numeriek resultaat. Van scores >6 is aangetoond dat ze goed correleren met kwantitatieve BAL (4). Recentere studies suggereren echter een lagere specificiteit die nog steeds kan leiden tot overmatig gebruik van antibiotica, maar deze benadering blijft nauwkeuriger dan een algemene klinische benadering. Het kan zinvoller zijn de CPIS serieel te gebruiken op het moment dat NP wordt vermoed en opnieuw na 72 uur. Bij patiënten met een aanvankelijk lage klinische verdenking op pneumonie (CPIS van 6 of minder) kunnen antibiotica na 72 uur veilig worden gestaakt als de CPIS laag blijft (5). Een dergelijke strategie kan nuttig zijn in settings waar meer geavanceerde diagnostische modaliteiten niet beschikbaar zijn.
Meerdere studies van biologische markers van infectie hebben geprobeerd een niet-invasieve, snelle, nauwkeurige manier te vinden om te bepalen wie antibiotica nodig heeft voor vermeende NP. Helaas zijn de resultaten grotendeels teleurstellend geweest. Recent werd aangetoond dat de meting van een oplosbare triggering receptor die tot expressie komt op myeloïde cellen (sTREM-1) en die geüpreguleerd wordt in de setting van infectie, ons vermogen om NP accuraat te diagnosticeren kan verbeteren. Meting van sTREM-1 was 98% gevoelig en 90% specifiek voor de diagnose van longontsteking bij mechanisch beademde patiënten (6). Hoewel veelbelovend, zijn meer gegevens nodig voordat deze test kan worden aanbevolen voor routinematig gebruik.
Management
Initiële behandeling
Vroeg beginnen met adequate empirische antibiotische therapie (d.w.z. dat is aangetoond dat de toegediende antibiotica actief zijn tegen alle geïsoleerde organismen) is geassocieerd met een betere overleving in vergelijking met initieel inadequate therapie (1,7). Antibiotica moeten onmiddellijk worden gestart na het verkrijgen van bloed- en sputummonsters voor kweek en mogen niet worden ingehouden in geval van vertraging in het diagnostisch onderzoek. De noodzaak om snel antibiotica te kiezen drijft het gebruik van breedspectrumantibiotica aan. Om onnodig overmatig gebruik van breedspectrumantibiotica te vermijden, moet de therapie worden gebaseerd op het risico op multidrugresistente (MDR) pathogenen. Door patiënten met een laag risico op MDR-pathogenen aan de hand van klinische criteria te identificeren, kan een beperktere, maar doeltreffendere antibioticatherapie worden gevolgd. Tot de patiënten met een laag risico behoren patiënten die hun pneumonie vroeg in de ziekenhuisopname ontwikkelen (<5-7 dagen), niet immuungecompromitteerd zijn, niet eerder breedspectrumantibiotica hebben gehad en geen risicofactoren voor HCAP hebben (tabel I) (1,7). Bij deze patiënten moeten antibiotica gericht zijn tegen veelvoorkomende, door de gemeenschap verworven organismen (tabel III – pathogenen met laag risico). Een geschikte initiële antibioticatherapie kan een cefalosporine van de derde generatie of een bèta-lactam/bèta-lactamaseremmer omvatten. In sommige gemeenschappen of ziekenhuisafdelingen kan de incidentie van methicillineresistentie onder Staphylococcus aureus-isolaten (MRSA) hoog genoeg zijn om een eerste empirische therapie met vancomycine of linezolid te rechtvaardigen.
 klik voor grote versie
klik voor grote versie
klik voor grote versie
Het is helaas onwaarschijnlijk dat de steeds complexer wordende gehospitaliseerde patiënten van vandaag de dag een “laag risico” vormen, vooral op intensivecareafdelingen.
Patiënten die niet aan de criteria voor een laag risico voldoen, worden beschouwd als patiënten met een hoog risico op MDR-pathogenen (tabel III-hoogrisicopathogenen). De aanvankelijke empirische therapie moet breed zijn en één antipseudomonaal middel (cefepepime of imipenem of bèta-lactam/bèta-lactamaseremmer) plus een fluorochinolon of aminoglycoside plus vancomycine of linezolid omvatten. De specifieke initiële empirische therapie moet worden bepaald door plaatselijke resistentiepatronen, kosten en beschikbaarheid van de gewenste middelen. Wanneer een dergelijke breed spectrum therapie wordt gestart, wordt het noodzakelijk dat antibiotica worden “gedeëscaleerd” om overmatig gebruik van antibiotica te beperken. De-escalatie therapie richt zich op het beperken van het antibiotica spectrum gebaseerd op kweekresultaten, en het beperken van de totale duur van de therapie. Ziekenhuisartsen moeten streven naar de-escalatie binnen 48-72 uur na het starten van breedspectrumantibiotica.
 klik voor grote versie
klik voor grote versie
klik voor grote versie
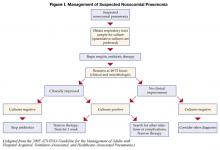
Volgende behandeling
Patiënten die zijn gestart met een eerste empirische antibioticatherapie voor vermoedelijke nosocomiale pneumonie, moeten na 48-72 uur opnieuw worden beoordeeld. Met name moeten kweken worden gecontroleerd en moet de klinische respons op de behandeling worden geëvalueerd. Figuur I beschrijft een algoritme voor het sturen van de behandeling (1). Bij patiënten die klinisch stabiel zijn en negatieve onderste luchtwegkweken hebben, kunnen antibiotica worden gestopt. Bij patiënten met positieve kweken moeten de antibiotica worden aangepast, of “gedeëscaleerd” op basis van de geïdentificeerde organismen. In het algemeen moet het meest smal spectrum antibioticum worden gebruikt dat werkzaam is tegen de geïsoleerde bacterie. Het gebruik van combinatietherapie voor gramnegatieve organismen (twee of meer antibiotica die werkzaam zijn tegen een bacterie-isolaat) wordt wijdverbreid toegepast om synergie te bereiken, of de ontwikkeling van resistentie te voorkomen. In afwezigheid van neutropenie is echter niet aangetoond dat combinatietherapie superieur is aan monotherapie (8), en wordt de voorkeur gegeven aan monotherapie. De isolatie van MRSA uit een respiratoir monster zou ook tot het gebruik van monotherapie moeten leiden. Hoewel sommige studies suggereren dat linezolid superieur is aan vancomycine voor MRSA-pneumonie, moet deze bevinding worden gevalideerd in prospectieve studies.
Een tweede component van de-escalatie is het verkorten van de totale duur van de therapie. De CPIS kan worden gebruikt om de duur van de therapie te verkorten bij patiënten met een laag risico op longontsteking. Onderzoekers van een Veterans Affairs medisch centrum randomiseerden patiënten die verdacht werden van NP, maar die een CPIS score < 6 hadden, naar ofwel behandeling gedurende 10-21 dagen, ofwel een korte kuur therapie. Patiënten die een korte kuur kregen, werden op dag 3 opnieuw beoordeeld, en als hun CPIS-score < 6 bleef, werden de antibiotica gestopt (5). De kortdurende therapiegroep had geen verschil in mortaliteit in vergelijking met de standaardbehandelingsgroep, maar had minder antibioticagebruik, een korter verblijf op de IC, en minder kans op het ontwikkelen van een superinfectie of infectie met een resistent organisme. Als de CPIS niet wordt gebruikt, of als men van mening is dat patiënten een hoger risico lopen of als overtuigend is aangetoond dat zij NP hebben, kan toch de voorkeur worden gegeven aan een kortere kuur. Uit een groot gerandomiseerd onderzoek bleek dat een antibioticakuur van 8 dagen bij patiënten met VAP vergelijkbare klinische resultaten opleverde in vergelijking met een kuur van 15 dagen. Bovendien werd een kortere antibioticakuur geassocieerd met een lagere kans op het ontwikkelen van latere infecties met multiresistente pathogenen. Een subgroep van patiënten in de behandelingsgroep van 8 dagen die geïnfecteerd waren met niet-fermenterende Gram-negatieve bacillen (bijv. Pseudomonas aeruginosa) had een hoger recidiefpercentage van pulmonale infecties, maar dankzij agressieve surveillance vertaalde dit zich niet in een hoger sterfterisico in deze subgroep van patiënten (9).
Samenvattend begint de behandeling van patiënten met verdenking op NP met onmiddellijke start van antibiotica en verzameling van respiratoire secreties. Hoewel patiënten met een laag risico een behandeling met een beperkter spectrum kunnen krijgen, zullen de meeste patiënten een brede initiële empirische therapie nodig hebben. Het antibioticakuur moet echter na 48-72 uur worden versoepeld op basis van microbiologische resultaten als de patiënt verbetert. Een totale behandelingsduur van 1 week is veilig en effectief met minder kans op bevordering van groei van resistente organismen. In de subset van patiënten met pseudomonale infecties moet een behandeling van 1 week worden gevolgd door actieve surveillance voor recidief, of als alternatief kan de behandeling worden verlengd tot twee weken.
Prognose
Als de behandeling voor NP eenmaal is gestart, wordt meestal binnen 48-72 uur klinische verbetering gezien. Er is weinig ondersteuning voor het volgen van de microbiologische respons (opheldering van positieve kweken) of de respons door radiografie van de borstkas. De röntgenfoto van de borst loopt vaak achter op de klinische respons, maar een duidelijk verslechterende CXR (>50% toename van infiltraat) binnen de eerste 48 uur kan wijzen op falen van de behandeling. Klinische resolutie zoals gemeten door temperatuur, aantal witte bloedcellen, en oxygenatie treedt gewoonlijk op na 6-7 dagen (10). Als de oxygenatie na 72 uur niet is verbeterd, is dit een indicatie voor het falen van de behandeling.
Het totale sterftecijfer bij patiënten met NP is 30-70%, grotendeels te wijten aan ernstige comorbide aandoeningen in de risicogroep. Hogere sterftecijfers worden gezien bij patiënten met VAP en resistente organismen. De mortaliteit die kan worden toegeschreven aan de episode van NP is ongeveer 30%, en kan worden teruggebracht tot <15% met de juiste antibiotische therapie (1).
Preventie
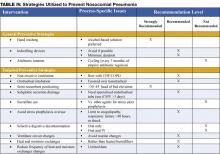
Preventieve strategieën zijn ofwel gericht op het verminderen van de algehele incidentie van infectieuze complicaties bij gehospitaliseerde patiënten, of ze zijn specifiek gericht op het verminderen van de incidentie van nosocomiale pneumonie (3). Het merendeel van de gegevens ter ondersteuning van preventieve strategieën is beperkt tot patiënten op de IC, en met name patiënten die mechanische beademing krijgen. Veel van de preventieve principes kunnen echter worden geëxtrapoleerd naar de niet-ICU-populatie. De preventieve strategieën worden belicht in tabel IV (blz. 18).
Algemene preventieve strategieën
Algemene preventieve strategieën zijn erop gericht besmetting van patiënten met in ziekenhuizen voorkomende antimicrobieel resistente organismen te voorkomen, of het ontstaan van antimicrobieel resistente organismen in de eerste plaats te beperken. Het voorkomen van iatrogene verspreiding van resistente organismen hangt af van zorgvuldige handhygiëne. Het wassen van de handen voor en na patiëntencontact vermindert de incidentie van nosocomiale infecties. Handspoelingen op alcoholbasis aan het bed kunnen zelfs beter zijn dan zeep en water, en bovendien de naleving van de handhygiëne verbeteren.
Het gebruik van verblijfsapparatuur (centrale lijnen, urinekatheters) beperken vermindert ook het ontstaan van resistente organismen. Wanneer deze hulpmiddelen toch nodig zijn, is het van cruciaal belang dat zij tijdig worden verwijderd. De controle op het gebruik van antibiotica staat centraal in veel preventiestrategieën. Langdurig of onnodig gebruik van breedspectrumantibiotica wordt sterk in verband gebracht met de ontwikkeling en kolonisatie van resistente organismen. Strategieën die zich richten op agressieve de-escalatie van antibiotica (hierboven beschreven) zijn een belangrijk preventief middel. Sommige instellingen hebben succes gehad met antibioticabeperking of -rotatie, maar langetermijngegevens over de effectiviteit van deze technieken ontbreken.
 klik voor grote versie
klik voor grote versie
klik voor grote versie
Gerichte preventieve strategieën
Preventieve strategieën om de incidentie van NP te verlagen richten zich op het verminderen van risicofactoren voor orofaryngeale of maagkolonisatie en daaropvolgende aspiratie van besmet orofaryngeaal of maagsecreet (1,3,7,11).
Endotracheale intubatie is een van de belangrijkste risicofactoren voor NP bij patiënten die beademingsondersteuning nodig hebben. Het gebruik van niet-invasieve beademing (NIV) of positieve druk maskerbeademing bij geselecteerde groepen patiënten is effectief gebleken in het voorkomen van nosocomiale pneumonie. Niet-invasieve beademing is het meest succesvol gebleken bij patiënten met acute exacerbaties van chronisch obstructieve longziekte (COPD) en longoedeem als gevolg van congestief hartfalen (CHF) en moet worden overwogen bij patiënten die daarvoor geschikt zijn. Wanneer intubatie nodig is, moet het gebruik van nasotracheale intubatie worden vermeden vanwege het hogere risico op NP in vergelijking met orotracheale intubatie.
Supine positionering kan bijdragen aan de ontwikkeling van NP, waarschijnlijk door een verhoogd risico op maagreflux en daaropvolgende aspiratie. Onderzoeken naar half liggende positie (elevatie van het hoofdeinde van het bed >45 graden) hebben minder reflux, minder aspiratie, en in één recent gerandomiseerd controleonderzoek, een significante vermindering van het aantal VAP’s aangetoond (12). Verhoging van het hoofdeinde van het bed is duidelijk geïndiceerd bij mechanisch beademde patiënten en is waarschijnlijk ook gunstig voor alle patiënten met een risico op aspiratie en daaropvolgende NP, hoewel deze techniek niet goed is onderzocht bij niet-geventileerde patiënten.
Subglottische secreetdrainage (SSD) omvat het verwijderen van samengevoegde secreten boven de manchet van een gespecialiseerde endotracheale buis die anders in de long zouden kunnen lekken. Een meta-analyse van vijf studies waarin deze nieuwe technologie werd geëvalueerd, liet een significante verlaging zien in de incidentie van VAP. Het gebruik van SSD moet worden overwogen bij patiënten die langer dan 3 dagen mechanische beademing nodig hebben (13).
Medicijnen die worden gebruikt voor de profylaxe van stress ulcera en die de pH-waarde van de maag verhogen – zoals H2-antagonisten en antacida – maken kolonisatie van het bovenste deel van het maagdarmkanaal door potentieel pathogene organismen mogelijk en verhogen daardoor het risico op NP. Het gebruik van sucralfaat in plaats van H2-antagonisten wordt geacht te leiden tot minder alkalinisatie van de maag en minder bacteriële overgroei. Het vermogen van sucralfaat om nosocomiale pneumonie te voorkomen is echter niet goed aangetoond en het routinematig gebruik ervan wordt niet aanbevolen (14). In plaats daarvan moeten inspanningen worden gericht op het beperken van het gebruik van stress ulcus profylaxe tot populaties met een hoog risico op klinisch significante bloedingen, namelijk patiënten met coagulopathie en langdurige beademingsstoornissen. De meeste patiënten die niet op de IC liggen zouden geen stress ulcus profylaxe moeten krijgen. Het risico van NP gerelateerd aan het gebruik van protonpompremmers is niet goed onderzocht.
Selectieve digestieve decontaminatie (SDD) omvat sterilisatie van de orofarynx en het maagdarmkanaal bij mechanisch beademde patiënten om aspiratie van grote aantallen potentieel pathogene organismen en daaropvolgende VAP te voorkomen. De meeste evaluaties van SDD omvatten orale (en soms maag) toepassing van topische polymixine, aminoglycoside, en amphotericine. In veel gevallen werden korte IV antibioticakuren toegevoegd. Ten minste 10 meta-analyses hebben een vermindering van het risico op VAP aangetoond bij het gebruik van SDD. De toevoeging van IV antibiotica kan ook een mortaliteitsvoordeel opleveren. Het langetermijnrisico op het ontstaan van resistente organismen en onvoldoende gegevens over de kosteneffectiviteit van SDD verhinderen echter de aanbeveling van routinematig gebruik (14).
Er zijn verschillende preventieve strategieën gericht op het verminderen van aspiratie van verontreinigingen in beademingscircuits, filters en slangen. Aanbevolen strategieën, opgesomd in Tabel III, pagina 16, omvatten het vermijden van routinematige vervanging van het beademingscircuit (vervang de slangen alleen wanneer ze zichtbaar verontreinigd zijn of voor een nieuwe patiënt), gebruik van warmte- en vochtwisselaars in plaats van verwarmde bevochtigers, en vermindering van de frequentie van vervanging van de warmte- en vochtwisselaars (1,11,14).
Follow-up plannen
Patiënten moeten in het ziekenhuis worden gevolgd totdat duidelijk is dat ze reageren op de therapie en klinisch verbeteren. Er is nog maar weinig onderzoek gedaan naar strategieën om patiënten snel over te laten gaan op orale therapie. Als patiënten echter verbeteren, orale therapie verdragen, een functionerend maagdarmkanaal hebben en een organisme geïsoleerd hebben dat gevoelig is voor beschikbare orale antibiotica, kan de overstap naar orale therapie gemaakt worden. Als er geen organisme geïsoleerd is, maar een patiënt wel degelijk NP heeft, moeten de orale antibiotica hetzelfde werkingsspectrum hebben als de eerder toegediende IV antibiotica. In veel gevallen zullen patiënten een infectie hebben met een organisme dat alleen gevoelig is voor IV antibiotica. Deze patiënten zullen waarschijnlijk ziek genoeg zijn om een volledige IV-kuur van een week in het ziekenhuis te volgen, maar als ze geen actieve co-morbide ziekte hebben en zijn opgeknapt, kan een PICC-lijn worden geplaatst (of een andere langdurige IV-toegang) en kunnen ze de rest van hun therapie thuis of in een andere omgeving met een lagere acuïteit krijgen.
Bij alle patiënten die NP ontwikkelen, moet worden gezocht naar reversibele oorzaken van aspiratie, en in gevallen waarin multidrug-resistente organismen worden geïsoleerd, moet dit worden gemeld aan elke instelling waarnaar een patiënt wordt overgeplaatst of aan de huisarts of de thuisverpleegkundige die de zorg overneemt na ontslag.
- Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med. 2005;171:388-416.
- Warren DK, Shukla SJ, Olsen MA, et al. Outcome and attributable cost of ventilator-associated pneumonia among intensive care unit patients in a suburban medical center. Crit Care Med. 2003;31:1312-7.
- Flanders SA, Collard HR, Saint S. Preventing Nosocomial Pneumonia. In: Lautenbach E, Woeltje K, eds. The Society for Healthcare Epidemiology of America: Practical Handbook for Healthcare Epidemiologists. Thorofare, NJ: Slack, 2004:69-78.
- Pugin J, Auckenthaler R, Mili N, Janssens JP, Lew PD, Suter PM. Diagnosis of ventilator-associated pneumonia by bacteriologic analysis of bronchoscopic and nonbronchoscopic “blind” bronchoalveolar lavage fluid. Am Rev Respir Dis. 1991;143:1121-9.
- Singh N, Rogers P, Atwood CW, Wagener MM, Yu VL. Short-course empiric antibiotic therapy for patients with pulmonary infiltrates in the intensive care unit. Een voorgestelde oplossing voor het ongedifferentieerd voorschrijven van antibiotica. Am J Respir Crit Care Med. 2000;162:505-11.
- Gibot S, Cravoisy A, Levy B, Bene MC, Faure G, Bollaert PE. Soluble triggering receptor expressed on myeloid cells and the diagnosis of pneumonia. N Engl J Med. 2004;350:451-8.
- Chastre J, Fagon JY. Ventilator-geassocieerde longontsteking. Am J Respir Crit Care Med. 2002;165:867-903.
- Paul M, Benuri-Silbiger I, Soares-Weiser K, Leibovici L. Beta lactam monotherapy versus beta lactam-aminoglycoside combination therapy for sepsis in immunocompetent patients: systematic review and metaanalyse of randomised trials. BMJ. 2004;328:668.
- Chastre J, Wolff M, Fagon JY, et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial. JAMA. 2003;290:2588-98.
- Dennesen PJ, van der Ven AJ, Kessels AG, Ramsay G, Bonten MJ. Resolution of infectious parameters after antimicrobial therapy in patients with ventilator-associated pneumonia. Am J Respir Crit Care Med. 2001;163:1371-5.
- Collard HR, Saint S, Matthay MA. Prevention of ventilator-associated pneumonia: an evidence-based systematic review. Ann Intern Med. 2003;138:494-501.
- Drakulovic MB, Torres A, Bauer TT, Nicolas JM, Nogue S, Ferrer M. Supine body position as a risk factor for nosocomial pneumonia in mechanically ventilated patients: a randomised trial. Lancet. 1999;354:1851-8.
- Dezfulian C, Shojania K, Collard HR, Kim HM, Matthay MA, Saint S. Subglottic secretion drainage for preventing ventilator-associated pneumonia: a metaanalysis. Am J Med. 2005;118:11-8.
- Dodek P, Keenan S, Cook D, et al. Evidence-based clinical practice guideline for the prevention of ventilator-associated pneumonia. Ann Intern Med. 2004;141:305-13.