Nosokomiale Pneumonie
(Dieses Kapitel wurde mit Genehmigung nachgedruckt aus Williams MV, Hayward R: Comprehensive Hospital Medicine, 1st edition. Philadelphia, WB Saunders, in press.)
Hintergrund
Nosokomiale Pneumonie (NP) ist die führende Todesursache bei Patienten, die an einer im Krankenhaus erworbenen Infektion sterben. Definiert als Pneumonie, die 48 Stunden oder mehr nach der Krankenhausaufnahme auftritt, umfasst NP auch die Untergruppe der beatmungsassoziierten Pneumonie (VAP), definiert als Pneumonie, die sich 48 bis 72 Stunden nach Beginn der mechanischen Beatmung entwickelt. Die Inzidenz der NP liegt zwischen 5 und 15 Fällen pro 1000 Krankenhauseinweisungen. Die Healthcare-assoziierte Pneumonie (HCAP), Teil des Kontinuums der NP, beschreibt einen zunehmend häufigeren Anteil der Pneumonien, die außerhalb des Krankenhauses entstehen (Tabelle I) (1). Diese Patienten, die typischerweise in einem Pflegeheim oder im betreuten Wohnen leben, sind einem Risiko für antibiotikaresistente Keime ausgesetzt und sollten ähnlich wie Fälle von nosokomialer Pneumonie behandelt werden, nicht wie Fälle von ambulant erworbener Pneumonie. Die meisten Daten, die unsere Diagnose- und Behandlungsentscheidungen in Bezug auf NP beeinflussen, stammen aus Studien, die an mechanisch beatmeten Patienten durchgeführt wurden, und werden extrapoliert, um Empfehlungen für nicht beatmete Patienten zu geben.
Die auf NP zurückzuführende Sterblichkeit ist umstritten, kann aber bis zu 30 % betragen. Das Vorhandensein einer nosokomialen Pneumonie erhöht die Verweildauer im Krankenhaus um durchschnittlich 7-10 Tage und verursacht im Falle einer VAP schätzungsweise Kosten zwischen 10.000 und 40.000 $ pro Fall (2).
Assessment
Klinische Präsentation
Zeichen und Symptome
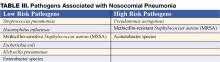
Die Diagnose einer nosokomialen Pneumonie wird in der Regel anhand klinischer Gründe gestellt. Typische Symptome und Anzeichen sind Fieber, Husten mit Auswurf und Kurzatmigkeit bei Hypoxie und einem neuen Infiltrat auf dem Thorax-Röntgenbild (CXR). Bei älteren Menschen können die Anzeichen subtiler sein, und Delirium, Fieber oder Leukozytose bei fehlendem Husten sollten Anlass zur Überlegung sein. Die Wahrscheinlichkeit einer NP steigt bei Patienten mit Risikofaktoren für Mikroaspiration, oropharyngeale Kolonisation oder das Überwachsen resistenter Organismen (Tabelle II) (3).
Differenzialdiagnose
Bevor die Diagnose NP gestellt wird, sollten alternative Ursachen für Fieber, Hypoxie und pulmonale Infiltrate in Betracht gezogen werden. Am häufigsten sind dies eine Lungenembolie, ein Lungenödem oder eine Atelektase. Alternative Infektionsquellen wie Harnwegsinfektionen, Haut- und Weichteilinfektionen und gerätebedingte Infektionen (z. B. zentrale Venenkatheter) sind bei hospitalisierten Patienten häufig und sollten vor der Diagnose einer nosokomialen Pneumonie ausgeschlossen werden.
 Für große Version anklicken
Für große Version anklicken
Für große Version anklicken
Diagnose
Diagnostische Strategien für NP zielen darauf ab, die Diagnose zu bestätigen und einen ätiologischen Erreger zu identifizieren, um so eine rechtzeitige, effektive und rationelle antibiotische Therapie zu ermöglichen. Leider gibt es keinen Konsens über den besten Ansatz zur Diagnose einer nosokomialen Pneumonie. Nachdem Sie ein komplettes Blutbild und Blutkulturen erhalten haben, können Sie zwischen einem klinischen oder mikrobiologischen diagnostischen Ansatz zur Diagnose wählen. Eine klinische Diagnose stützt sich auf ein neues oder fortschreitendes radiologisches Infiltrat zusammen mit Anzeichen einer Infektion wie Fieber, Leukozytose oder eitrigem Sputum. Die klinische Diagnose ist sensitiv, führt aber wahrscheinlich zu einem übermäßigen Einsatz von Antibiotika. Der mikrobiologische Ansatz erfordert die Entnahme von Sekretproben aus den Atemwegen und kann den unangemessenen Einsatz von Antibiotika reduzieren, dauert aber länger und ist nicht in allen Krankenhäusern verfügbar.
Bevorzugte Studien
Der mikrobiologische Ansatz zur Diagnose beruht auf der Verwendung von quantitativen oder halbquantitativen Kulturen, um Schwellenwerte für die Antibiotikabehandlung festzulegen. Bakterienkulturen, die ein Wachstum oberhalb der unten beschriebenen Schwellenwerte zeigen, rechtfertigen eine Behandlung, während diejenigen unterhalb dieser Schwellenwerte das Zurückhalten oder Absetzen von Antibiotika auslösen sollten.
Bronchoskopische Ansätze: Die bronchoalveoläre Lavage (BAL) mit einem Grenzwert von 10 (4) Organismen/ml oder die geschützte Probenbürste (PSB) mit einem Grenzwert von 10 (3) Organismen/ml gelten als die spezifischsten diagnostischen Tests, wenn sie vor der Einleitung von Antibiotika oder vor dem Wechsel von Antibiotika durchgeführt werden, wenn ein Patient diese bereits erhält. Bei klinisch stabilen Patienten können die Antibiotika sicher abgesetzt werden, wenn das Bakterienwachstum unter die Grenzwerte fällt. Wenn die Kulturen positiv sind, sollte die Antibiotikatherapie auf den identifizierten Organismus abgestimmt werden. Der bronchoskopische Ansatz wird bei Patienten bevorzugt, die mechanisch beatmet werden, ihre Pneumonie spät im Krankenhausaufenthalt entwickeln (>5-7 Tage), ein Risiko für ungewöhnliche Erreger haben, bei denen die Therapie versagt oder bei denen der Verdacht auf eine andere Diagnose besteht.
Nicht-bronchoskopische Ansätze: Qualitative endotracheale Aspirate (ETA) haben sich bei beatmeten Patienten als recht sensitiv erwiesen, identifizieren regelmäßig Organismen, die anschließend durch BAL oder PSB gefunden werden können, und sollten, wenn sie negativ sind, zum Zurückhalten von Antibiotika führen. Quantitative endotracheale Aspirate mit einem Cutoff von 10 (6) Organismen/ml werden oft empfohlen, um eine Überversorgung mit Antibiotika zu reduzieren, aber die Ergebnisse sollten mit Vorsicht interpretiert werden, da sie nur eine Sensitivität und Spezifität von etwa 75 % haben (1). Es sollte in Betracht gezogen werden, Antibiotika bei einem klinisch stabilen Patienten mit einer negativen quantitativen ETA zurückzuhalten, wenn die Antibiotika in den vorangegangenen 72 Stunden nicht gewechselt wurden. Viele Intensivstationen haben damit begonnen, verblindete Probenahmen von Sekreten der unteren Atemwege mit Absaugkathetern durchzuführen (blind PSB, blind mini-BAL). Diese Techniken können zu jeder Zeit von geschulten Atemtherapeuten oder Krankenschwestern durchgeführt werden, liefern ähnliche Kulturdaten wie die Bronchoskopie und sind möglicherweise sicherer und kostengünstiger als die Bronchoskopie. Im Allgemeinen werden nicht-bronchoskopische Techniken bei Patienten, die nicht mechanisch beatmet werden, bevorzugt. Sputumproben sind zwar einfach zu gewinnen, wurden aber bei NP nicht gut untersucht. Bei Patienten, bei denen bronchoskopische oder andere nicht-bronchoskopische Techniken nicht durchführbar sind, kann jedoch eine Sputum-Probeentnahme durchgeführt werden, um potenziell resistente Organismen zu identifizieren und die Therapie anzupassen.
Alternative Optionen
Clinical Pulmonary Infection Score-Combining Clinical and Microbiologic Approaches
Die klinische Diagnose einer nosokomialen Pneumonie (neues Infiltrat + Fieber, Leukozytose oder eitriges Sputum) führt wahrscheinlich zu einem Antibiotika-Übergebrauch, doch die Verfolgung einer bronchoskopischen Diagnose ist invasiv, kostspielig und erfordert technisches Know-how. Die oben diskutierte quantitative ETA, blinde PSB und blinde BAL sind Beispiele für einige Kompromisse, die die Notwendigkeit einer Bronchoskopie vermeiden, aber mikrobiologische Daten hinzufügen, um eine übermäßige Antibiotikatherapie zu verhindern. Die formale Kombination diagnostischer Ansätze (klinisch + mikrobiologisch) kann ebenfalls sinnvoll sein. Eine solche Option ist die Verwendung des klinischen Lungeninfektions-Scores (CPIS), der klinische, radiologische, physiologische und mikrobiologische Daten zu einem numerischen Ergebnis kombiniert. Scores >6 haben gezeigt, dass sie gut mit der quantitativen BAL korrelieren (4). Neuere Studien deuten jedoch auf eine geringere Spezifität hin, die immer noch zu einer Überversorgung mit Antibiotika führen könnte, aber dieser Ansatz bleibt genauer als ein allgemeiner klinischer Ansatz. Die serielle Anwendung des CPIS zum Zeitpunkt des NP-Verdachts und erneut nach 72 Stunden kann nützlicher sein. Bei Patienten mit einem anfänglichen niedrigen klinischen Verdacht auf eine Lungenentzündung (CPIS von 6 oder weniger) könnten die Antibiotika nach 72 Stunden sicher abgesetzt werden, wenn der CPIS niedrig bleibt (5). Eine solche Strategie kann in Situationen nützlich sein, in denen anspruchsvollere Diagnosemethoden nicht zur Verfügung stehen.
Mehrere Studien zu biologischen Infektionsmarkern haben versucht, ein nicht-invasives, schnelles und genaues Mittel zu finden, um zu bestimmen, wer Antibiotika für vermutete NP benötigt. Leider waren die Ergebnisse weitgehend enttäuschend. In jüngster Zeit hat sich gezeigt, dass die Messung eines löslichen, auf myeloischen Zellen exprimierten Triggerrezeptors (sTREM-1), der im Rahmen einer Infektion hochreguliert wird, unsere Fähigkeit zur genauen Diagnose von NP verbessern kann. Die Messung von sTREM-1 war zu 98 % sensitiv und zu 90 % spezifisch für die Diagnose einer Lungenentzündung bei mechanisch beatmeten Patienten (6). Obwohl vielversprechend, werden weitere Daten benötigt, bevor dieser Test für den routinemäßigen Einsatz empfohlen werden kann.
Management
Erstbehandlung
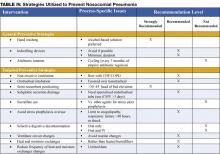
Eine frühzeitige Einleitung einer adäquaten empirischen Antibiotikatherapie (d. h. die verabreichten Antibiotika sind nachweislich gegen alle isolierten Organismen wirksam) ist mit einer verbesserten Überlebensrate im Vergleich zu einer anfänglich inadäquaten Therapie verbunden (1,7). Antibiotika sollten sofort nach der Gewinnung von Blut- und Sputumproben für die Kultur begonnen werden und sollten bei einer Verzögerung der diagnostischen Tests nicht zurückgehalten werden. Die Notwendigkeit, Antibiotika schnell und zügig auszuwählen, treibt den Einsatz von Breitspektrum-Antibiotika voran. Um einen unnötigen Übergebrauch von Breitspektrum-Antibiotika zu vermeiden, sollte die Therapie auf dem Risiko für multiresistente (MDR) Erreger basieren. Die Identifizierung von Patienten mit geringem Risiko für MDR-Erreger anhand klinischer Kriterien ermöglicht eine engmaschigere, aber effektive Antibiotikatherapie. Zu den Patienten mit niedrigem Risiko gehören diejenigen, die ihre Pneumonie früh im Krankenhausaufenthalt entwickeln (<5-7 Tage), nicht immungeschwächt sind, keine vorherigen Breitspektrum-Antibiotika erhalten haben und keine Risikofaktoren für HCAP haben (Tabelle I) (1,7). Bei diesen Patienten sollten Antibiotika auf häufige, in der Gemeinschaft erworbene Organismen abzielen (Tabelle III – Erreger mit geringem Risiko). Eine geeignete initiale Antibiotikatherapie könnte ein Cephalosporin der dritten Generation oder ein Beta-Lactam/Beta-Lactamase-Inhibitor umfassen. In einigen Gemeinden oder Krankenhausabteilungen kann die Inzidenz von Methicillin-Resistenz unter Staphylococcus aureus-Isolaten (MRSA) hoch genug sein, um eine initiale empirische Therapie mit Vancomycin oder Linezolid zu rechtfertigen.
 Für große Version anklicken
Für große Version anklickenUnglücklicherweise sind die heutigen, immer komplexer werdenden hospitalisierten Patienten wahrscheinlich nicht „risikoarm“, besonders auf Intensivstationen.
Patienten, die die Kriterien für ein niedriges Risiko nicht erfüllen, gelten als Patienten mit hohem Risiko für MDR-Erreger (Tabelle III-Hochrisiko-Erreger). Die initiale empirische Therapie muss breit gefächert sein und sollte einen antipseudomonalen Wirkstoff (Cefepim oder Imipenem oder Beta-Lactam/Beta-Lactamase-Inhibitor) plus ein Fluorchinolon oder Aminoglykosid plus Vancomycin oder Linezolid umfassen. Die spezifische initiale empirische Therapie sollte von den lokalen Resistenzmustern, den Kosten und der Verfügbarkeit der bevorzugten Wirkstoffe bestimmt werden. Wenn eine solche Breitspektrumtherapie eingeleitet wird, ist es zwingend erforderlich, dass die Antibiotika „deeskaliert“ werden, um den Antibiotikaübergebrauch zu begrenzen. Die Deeskalationstherapie konzentriert sich auf die Eingrenzung des Antibiotikaspektrums auf der Grundlage der Kulturergebnisse und die Begrenzung der Gesamtdauer der Therapie. Krankenhausärzte sollten darauf abzielen, eine solche Deeskalation innerhalb von 48-72 Stunden nach der Einleitung von Breitbandantibiotika durchzuführen.
 Für große Version anklicken
Für große Version anklicken
Für große Version anklicken
Folgebehandlung
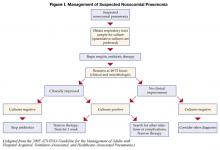
Patienten, die mit einer initialen empirischen Antibiotikatherapie bei vermuteter nosokomialer Pneumonie begonnen haben, sollten nach 48-72 Stunden erneut untersucht werden. Insbesondere sollten die Kulturen überprüft und das klinische Ansprechen auf die Behandlung bewertet werden. Abbildung I beschreibt einen Algorithmus zur Steuerung der Behandlung (1). Bei Patienten, die klinisch stabil sind und negative Kulturen der unteren Atemwege haben, können Antibiotika abgesetzt werden. Bei Patienten mit positiven Kulturen sollte die Antibiotikabehandlung auf die identifizierten Organismen abgestimmt oder „deeskaliert“ werden. Im Allgemeinen sollte das Antibiotikum mit dem engsten Spektrum verwendet werden, das gegen die isolierten Bakterien wirksam ist. Die Verwendung einer Kombinationstherapie für gramnegative Organismen (zwei oder mehr Antibiotika, die gegen ein bakterielles Isolat aktiv sind) ist weit verbreitet, um Synergien zu erzielen oder die Entwicklung von Resistenzen zu verhindern. Bei fehlender Neutropenie hat sich die Kombinationstherapie jedoch nicht als überlegen gegenüber der Monotherapie erwiesen (8), und die Monotherapie wird bevorzugt. Die Isolierung von MRSA aus einer respiratorischen Probe sollte ebenfalls zur Anwendung einer Monotherapie führen. Während einige Studien darauf hindeuten, dass Linezolid bei MRSA-Pneumonien dem Vancomycin überlegen sein könnte, muss dieser Befund in prospektiven Studien validiert werden.
Eine zweite Komponente der Deeskalation ist die Verkürzung der Gesamtdauer der Therapie. Die CPIS kann zur Verkürzung der Therapiedauer bei Patienten mit geringem Risiko für eine Lungenentzündung eingesetzt werden. Die Forscher eines medizinischen Zentrums für Veteranenangelegenheiten randomisierten Patienten, bei denen der Verdacht auf eine Lungenentzündung bestand, die aber einen CPIS-Score < 6 hatten, entweder auf eine Behandlung von 10-21 Tagen oder eine Kurzzeittherapie. Patienten, die eine Kurzzeittherapie erhielten, wurden an Tag 3 erneut untersucht, und wenn ihr CPIS-Score < 6 blieb, wurden die Antibiotika abgesetzt (5). Die Gruppe mit der Kurzzeittherapie hatte keinen Unterschied in der Sterblichkeit im Vergleich zur Gruppe mit der Standardbehandlung, hatte aber einen geringeren Antibiotikaverbrauch, kürzere Aufenthalte auf der Intensivstation und eine geringere Wahrscheinlichkeit, eine Superinfektion oder eine Infektion mit einem resistenten Organismus zu entwickeln. Wenn die CPIS nicht verwendet wird, oder wenn Patienten ein höheres Risiko haben oder überzeugend nachgewiesen wurde, dass sie NP haben, kann eine kürzere Therapie trotzdem bevorzugt werden. Eine große randomisierte Studie zeigte, dass eine 8-tägige Antibiotikatherapie bei Patienten mit VAP im Vergleich zu einer 15-tägigen Therapie zu ähnlichen klinischen Ergebnissen führte. Darüber hinaus war eine kürzere Dauer der Antibiotikatherapie mit einer geringeren Wahrscheinlichkeit verbunden, nachfolgende Infektionen mit multiresistenten Erregern zu entwickeln. Eine Untergruppe von Patienten in der 8-Tage-Behandlungsgruppe, die mit nicht-fermentierenden gramnegativen Bazillen (z. B. Pseudomonas aeruginosa) infiziert waren, hatte zwar eine höhere Rezidivrate der pulmonalen Infektion, aber aufgrund der aggressiven Überwachung führte dies nicht zu einem höheren Mortalitätsrisiko in dieser Untergruppe von Patienten (9).
Zusammenfassend lässt sich sagen, dass die Behandlung von Patienten mit Verdacht auf NP mit der sofortigen Einleitung von Antibiotika und der Sammlung von Atemwegssekreten beginnt. Während Patienten mit niedrigem Risiko eine Therapie mit einem engeren Spektrum erhalten können, benötigen die meisten Patienten eine breite initiale empirische Therapie. Das Antibiotikaregime sollte jedoch nach 48-72 Stunden auf der Grundlage der mikrobiologischen Ergebnisse eingegrenzt werden, wenn sich der Zustand des Patienten verbessert. Eine Gesamtbehandlungsdauer von 1 Woche ist sicher und effektiv mit geringerer Chance, das Wachstum resistenter Organismen zu fördern. Bei der Untergruppe der Patienten mit pseudomonalen Infektionen sollte nach einer einwöchigen Behandlung eine aktive Überwachung auf ein Rezidiv erfolgen, alternativ kann die Behandlung auf zwei Wochen verlängert werden.
Prognose
Wenn die Behandlung von NP eingeleitet wird, ist eine klinische Verbesserung in der Regel nach 48-72 Stunden zu beobachten. Es gibt wenig Unterstützung dafür, entweder das mikrobiologische Ansprechen (Beseitigung positiver Kulturen) oder das Ansprechen anhand der Thorax-Röntgenaufnahme zu verfolgen. Das Röntgenbild des Brustkorbs hinkt oft dem klinischen Ansprechen hinterher, jedoch kann eine deutliche Verschlechterung des Röntgenbildes (>50% Zunahme des Infiltrats) innerhalb der ersten 48 Stunden auf ein Versagen der Behandlung hinweisen. Eine klinische Besserung, gemessen an Temperatur, Anzahl der weißen Blutkörperchen und Oxygenierung, tritt normalerweise nach 6-7 Tagen ein (10). Bessert sich die Oxygenierung nach 72 Stunden nicht, ist dies ein Hinweis auf ein Versagen der Behandlung.
Die Gesamtmortalität bei Patienten mit NP liegt bei 30-70 %, was größtenteils auf schwere komorbide Erkrankungen in der Risikopopulation zurückzuführen ist. Höhere Mortalitätsraten werden bei Patienten mit VAP und resistenten Organismen beobachtet. Die Sterblichkeit, die auf die Episode der NP zurückzuführen ist, liegt bei etwa 30 % und kann mit einer angemessenen Antibiotikatherapie auf <15 % gesenkt werden (1).
Prävention
Präventive Strategien zielen entweder darauf ab, die Gesamthäufigkeit infektiöser Komplikationen bei hospitalisierten Patienten zu reduzieren, oder sie sind speziell darauf ausgerichtet, die Häufigkeit nosokomialer Pneumonien zu verringern (3). Der Großteil der Daten, die präventive Strategien unterstützen, ist auf Patienten auf der Intensivstation und insbesondere auf Patienten, die mechanisch beatmet werden, beschränkt. Viele der präventiven Prinzipien können jedoch auf die nicht-ICU-Population extrapoliert werden. Die präventiven Strategien sind in Tabelle IV (Seite 18) hervorgehoben.
Allgemeine präventive Strategien
Allgemeine präventive Strategien zielen darauf ab, die Kontamination von Patienten mit antimikrobiell resistenten Organismen, die in Krankenhäusern vorkommen, zu vermeiden oder das Auftreten von antimikrobiell resistenten Organismen von vornherein zu vermindern. Die Verhinderung der iatrogenen Verbreitung resistenter Organismen hängt von einer sorgfältigen Händehygiene ab. Händewaschen vor und nach Patientenkontakt reduziert die Inzidenz von nosokomialen Infektionen. Handspülungen auf Alkoholbasis, die am Krankenbett platziert werden, können Seife und Wasser sogar überlegen sein und darüber hinaus die Compliance bei der Handhygiene verbessern.
Die Minimierung des Einsatzes von Verweilvorrichtungen (Zentralkatheter, Blasenkatheter) reduziert ebenfalls das Auftreten von resistenten Keimen. Wenn diese Geräte notwendig sind, ist es wichtig, sich auf ihre rechtzeitige Entfernung zu konzentrieren. Die Kontrolle des Antibiotikaeinsatzes ist ein zentraler Bestandteil vieler Präventionsstrategien. Der verlängerte oder unnötige Einsatz von Breitspektrum-Antibiotika steht in engem Zusammenhang mit der Entwicklung und Besiedlung von resistenten Organismen. Strategien, die sich auf eine aggressive Deeskalation des Antibiotikaeinsatzes konzentrieren (siehe oben), sind ein wichtiges Präventionsinstrument. Einige Einrichtungen haben mit der Einschränkung oder Rotation von Antibiotika Erfolg gehabt, aber es fehlen Langzeitdaten über die Wirksamkeit dieser Techniken.
 Für große Version anklicken
Für große Version anklickenFür große Version anklicken
Gezielte präventive Strategien
Präventive Strategien zur Senkung der Inzidenz von NP konzentrieren sich auf die Reduktion von Risikofaktoren für eine oropharyngeale oder gastrische Kolonisation und die anschließende Aspiration von kontaminierten oropharyngealen oder gastrischen Sekreten (1,3,7,11).
Die endotracheale Intubation ist einer der wichtigsten Risikofaktoren für NP bei Patienten, die eine Beatmungsunterstützung benötigen. Der Einsatz von nicht-invasiver Beatmung (NIV) oder positiver Druckmaskenbeatmung bei ausgewählten Patientengruppen hat sich als wirksam bei der Prävention nosokomialer Pneumonien erwiesen. Die nicht-invasive Beatmung hat sich bei Patienten mit akuten Exazerbationen der chronisch obstruktiven Lungenerkrankung (COPD) und Lungenödemen infolge von Herzinsuffizienz (CHF) am besten bewährt und sollte bei entsprechend ausgewählten Patienten in Betracht gezogen werden. Wenn eine Intubation erforderlich ist, sollte die nasotracheale Intubation aufgrund der höheren Raten von NP im Vergleich zur orotrachealen Intubation vermieden werden.
Supine Lagerung kann zur Entwicklung von NP beitragen, wahrscheinlich aufgrund eines erhöhten Risikos von Magenreflux und anschließender Aspiration. Studien zur halbliegenden Lagerung (Erhöhung des Kopfteils des Bettes >45 Grad) haben weniger Reflux, weniger Aspiration und in einer kürzlich durchgeführten randomisierten Kontrollstudie eine signifikante Reduzierung der VAP-Rate gezeigt (12). Die Hochlagerung des Kopfteils ist bei mechanisch beatmeten Patienten eindeutig indiziert und kommt wahrscheinlich auch allen Patienten zugute, bei denen ein Risiko für Aspiration und nachfolgende VAP besteht, obwohl diese Technik bei nicht beatmeten Patienten nicht gut untersucht wurde.
Die subglottische Sekretdrainage (SSD) beinhaltet die Entfernung von Sekretansammlungen oberhalb der Manschette eines speziellen Endotrachealtubus, die sonst in die Lunge gelangen könnten. Eine Meta-Analyse von fünf Studien, die diese neue Technologie untersuchten, zeigte eine signifikante Reduktion der VAP-Inzidenz. Der Einsatz von SSD sollte bei Patienten, die länger als 3 Tage mechanisch beatmet werden müssen, in Erwägung gezogen werden (13).
Medikamente, die zur Prophylaxe von Stressulcera eingesetzt werden und den pH-Wert des Magens erhöhen – wie H2-Antagonisten und Antazida – ermöglichen eine Besiedlung des oberen Gastrointestinaltrakts mit potenziell pathogenen Organismen und erhöhen somit das Risiko für NP. Die Verwendung von Sucralfat anstelle von H2-Antagonisten soll zu einer geringeren Alkalisierung des Magens und einer geringeren bakteriellen Überbesiedlung führen. Die Fähigkeit von Sucralfat, nosokomiale Pneumonien zu verhindern, ist jedoch nicht gut belegt, und seine routinemäßige Anwendung wird nicht empfohlen (14). Stattdessen sollten die Bemühungen darauf abzielen, die Verwendung der Stressulkusprophylaxe auf Populationen mit hohem Risiko für klinisch signifikante Blutungen zu beschränken, nämlich Patienten mit Koagulopathie und längerem Beatmungsversagen. Die meisten Patienten, die sich nicht auf der Intensivstation befinden, sollten keine Stressulkusprophylaxe erhalten. Das Risiko von NP im Zusammenhang mit der Verwendung von Protonenpumpeninhibitoren ist nicht gut untersucht.
Die selektive Dekontamination des Verdauungstrakts (SDD) beinhaltet die Sterilisation des Oropharynx und des Gastrointestinaltrakts bei mechanisch beatmeten Patienten, um die Aspiration einer großen Anzahl potenziell pathogener Organismen und die nachfolgende VAP zu verhindern. Die meisten Bewertungen der SDD haben die orale (und manchmal auch die gastrische) Anwendung von topischem Polymixin, Aminoglykosid und Amphotericin beinhaltet. In vielen Fällen wurden kurze Kurse von IV-Antibiotika hinzugefügt. Mindestens 10 Meta-Analysen haben eine Verringerung des VAP-Risikos durch den Einsatz von SDD gezeigt. Die Zugabe von IV-Antibiotika kann auch einen Mortalitätsvorteil bieten. Das langfristige Risiko für das Auftreten resistenter Organismen und unzureichende Daten zur Kosteneffektivität von SDD verhindern jedoch eine Empfehlung für den routinemäßigen Einsatz (14).
Es gibt mehrere präventive Strategien, die darauf abzielen, die Aspiration von Verunreinigungen in Beatmungskreisläufen, Filtern und Schläuchen zu reduzieren. Zu den empfohlenen Strategien, die in Tabelle III, Seite 16, aufgeführt sind, gehören die Vermeidung von routinemäßigen Wechseln des Beatmungskreislaufs (wechseln Sie die Schläuche nur, wenn sie sichtbar kontaminiert sind oder für einen neuen Patienten), die Verwendung von Wärme- und Feuchtigkeitstauschern anstelle von beheizten Befeuchtern und die Verringerung der Häufigkeit von Wechseln der Wärme- und Feuchtigkeitstauscher (1,11,14).
Entlassungs-/Nachbeobachtungspläne
Patienten sollten im Krankenhaus nachbeobachtet werden, bis klar ist, dass sie auf die Therapie ansprechen und sich klinisch verbessern. Es gibt nur wenige Untersuchungen zu Strategien, um Patienten schnell auf eine orale Therapie umzustellen. Wenn es den Patienten jedoch besser geht, sie die orale Therapie vertragen, einen funktionierenden Magen-Darm-Trakt haben und ein Organismus isoliert wurde, der auf verfügbare orale Antibiotika empfindlich ist, kann die Umstellung auf eine orale Therapie erfolgen. Wenn kein Organismus isoliert wird, aber ein Patient definitiv NP hat, sollten die gewählten oralen Antibiotika das gleiche Wirkungsspektrum haben wie die zuvor verabreichten IV-Antibiotika. In vielen Fällen haben Patienten eine Infektion mit einem Organismus, der nur für IV-Antibiotika empfindlich ist. Diese Patienten sind wahrscheinlich krank genug, um eine volle einwöchige IV-Kur im Krankenhaus zu absolvieren, aber wenn sie keine aktiven komorbiden Erkrankungen haben und sich gebessert haben, können sie eine PICC-Leitung (oder einen anderen Langzeit-IV-Zugang) legen lassen und den Rest ihrer Therapie zu Hause oder in einer anderen Umgebung mit geringerer Akuität erhalten.
Bei allen Patienten, die eine NP entwickeln, sollte nach reversiblen Ursachen für die Aspiration gesucht werden, und in Fällen, in denen multiresistente Organismen isoliert werden, sollte dies jeder Einrichtung mitgeteilt werden, in die ein Patient verlegt wird, oder dem Hausarzt oder der häuslichen Krankenschwester, die nach der Entlassung die Pflege übernimmt.
- Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med. 2005;171:388-416.
- Warren DK, Shukla SJ, Olsen MA, et al. Outcome and attributable cost of ventilator-associated pneumonia among intensive care unit patients in a suburban medical center. Crit Care Med. 2003;31:1312-7.
- Flanders SA, Collard HR, Saint S. Preventing Nosocomial Pneumonia. In: Lautenbach E, Woeltje K, eds. The Society for Healthcare Epidemiology of America: Practical Handbook for Healthcare Epidemiologists. Thorofare, NJ: Slack, 2004:69-78.
- Pugin J, Auckenthaler R, Mili N, Janssens JP, Lew PD, Suter PM. Diagnose von beatmungsassoziierter Pneumonie durch bakteriologische Analyse von bronchoskopischer und nichtbronchoskopischer „blinder“ bronchoalveolärer Lavageflüssigkeit. Am Rev Respir Dis. 1991;143:1121-9.
- Singh N, Rogers P, Atwood CW, Wagener MM, Yu VL. Short-course empiric antibiotic therapy for patients with pulmonary infiltrates in the intensive care unit. Ein Lösungsvorschlag für die wahllose Verschreibung von Antibiotika. Am J Respir Crit Care Med. 2000;162:505-11.
- Gibot S, Cravoisy A, Levy B, Bene MC, Faure G, Bollaert PE. Löslicher Triggerrezeptor, der auf myeloischen Zellen exprimiert wird, und die Diagnose einer Lungenentzündung. N Engl J Med. 2004;350:451-8.
- Chastre J, Fagon JY. Ventilator-assoziierte Pneumonie. Am J Respir Crit Care Med. 2002;165:867-903.
- Paul M, Benuri-Silbiger I, Soares-Weiser K, Leibovici L. Beta lactam monotherapy versus beta lactam-aminoglycoside combination therapy for sepsis in immunocompetent patients: systematic review and metaanalysis of randomised trials. BMJ. 2004;328:668.
- Chastre J, Wolff M, Fagon JY, et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial. JAMA. 2003;290:2588-98.
- Dennesen PJ, van der Ven AJ, Kessels AG, Ramsay G, Bonten MJ. Auflösung der infektiösen Parameter nach antimikrobieller Therapie bei Patienten mit beatmungsassoziierter Pneumonie. Am J Respir Crit Care Med. 2001;163:1371-5.
- Collard HR, Saint S, Matthay MA. Prevention of ventilator-associated pneumonia: an evidence-based systematic review. Ann Intern Med. 2003;138:494-501.
- Drakulovic MB, Torres A, Bauer TT, Nicolas JM, Nogue S, Ferrer M. Supine body position as a risk factor for nosocomial pneumonia in mechanically ventilated patients: a randomised trial. Lancet. 1999;354:1851-8.
- Dezfulian C, Shojania K, Collard HR, Kim HM, Matthay MA, Saint S. Subglottic secretion drainage for preventing ventilator-associated pneumonia: a metaanalysis. Am J Med. 2005;118:11-8.
- Dodek P, Keenan S, Cook D, et al. Evidence-based clinical practice guideline for the prevention of ventilator-associated pneumonia. Ann Intern Med. 2004;141:305-13.