Creative Proteomics Blog
Western blot został wprowadzony przez Towbin et al. w 1979 roku, jest to powszechnie stosowana metoda analizy białek. Może być stosowany do jakościowej i półilościowej analizy białek. Do wykonania Western Blot potrzebne są trzy elementy, rozdzielenie białek według wielkości, przeniesienie białek na podłoże stałe oraz znakowanie białek przeciwciałami pierwotnymi i wtórnymi w celu wizualizacji.
Zasada Western Blot
Western Blot jest wykonywany przy użyciu elektroforezy na żelu polipropylenowym. SDS-PAGE pozwala na rozdzielenie próbek białek i przeniesienie ich na stałe podłoże, takie jak nitroceluloza (NC) lub membrana z polifluorku winylidenu (PVDF). Podłoże stałe może wchłonąć białko i utrzymać jego aktywność biologiczną na niezmienionym poziomie. Przeniesiona membrana na podłoże stałe nazywana jest blotem i jest traktowana roztworem białka w celu zablokowania hydrofobowego miejsca wiązania na membranie. Membrana jest traktowana przeciwciałem (przeciwciałem pierwotnym) dla docelowych białek. Tylko białka, które mają być badane, mogą specyficznie wiązać się z przeciwciałem pierwotnym, tworząc kompleks antygen-przeciwciało. Po wypłukaniu i usunięciu pierwotnego przeciwciała, tylko pozycja docelowego białka wiąże się z pierwotnym przeciwciałem. Membrany poddane działaniu przeciwciała pierwotnego są po przemyciu poddawane działaniu znakowanego przeciwciała wtórnego. Po obróbce, znakowane przeciwciało drugorzędowe, które wiąże się z przeciwciałem pierwszorzędowym, tworzy kompleks przeciwciała, który może wskazywać lokalizację przeciwciała pierwszorzędowego, zarówno lokalizację badanego białka.
Procedura Western Blot
Istnieje sześć etapów związanych z Western Blot, w tym przygotowanie próbki, elektroforeza żelowa, transfer białek, blokowanie, inkubacja przeciwciał oraz wykrywanie i wizualizacja białek.
1. Przygotowanie próbki.
Białka mogą być ekstrahowane z różnych próbek, takich jak tkanki lub komórki. Ponieważ próbki tkanek wykazują wyższy stopień struktury, tkanki są najpierw rozbijane za pomocą wynalazku mechanicznego, takiego jak homogenizator lub sonikacja. Inhibitory proteazy i fosfatazy są powszechnie stosowane, aby zapobiec trawieniu próbki w niskich temperaturach. Po ekstrakcji białek, ważne jest, aby wykryć stężenie białek, co pozwala na masę białek załadowanych do każdej studzienki. A spektrofotometr jest często używany do stężenia białek.
2. elektroforeza żelowa.

Najczęściej używanym żelem jest żel poliakrylamidowy (PAG) i bufory obciążone dodecylosiarczanem sodu (SDS). Western blot wykorzystuje dwa rodzaje żeli agarozowych: żel układający, który służy do skupiania wszystkich białek w jednym paśmie oraz żel rozdzielający, który pozwala na rozdzielenie białek w zależności od ich masy cząsteczkowej. Mniejsze białka migrują szybciej w SDS-PAGE, gdy przyłożone jest napięcie. PAGE może rozdzielać białka o masie od 5 do 2000 kDa dzięki jednolitemu rozmiarowi porów, który jest kontrolowany przez różne stężenia PAG. Zazwyczaj żele rozdzielające wykonuje się w stężeniu 5%, 8%, 10%, 12% lub 15%. Wybierając odpowiedni procent żelu rozdzielającego, powinniśmy wziąć pod uwagę wielkość docelowych białek. Im mniejsza jest znana masa białek, tym wyższy procent żeli powinien być używany.
3. Transfer białek.
Po oddzieleniu białek przez elektroforezę żelową, białka są przenoszone z wnętrza żelu na stałą membranę nośną, aby białka dostępne do wykrywania przeciwciał. Główną metodą przenoszenia białek jest tzw. elektroblotting, który wykorzystuje pole elektryczne zorientowane prostopadle do powierzchni żelu, aby wyciągnąć białka z żelu i przenieść do membrany. Można to robić w warunkach półsuchych lub mokrych, przy czym warunki mokre są zwykle bardziej niezawodne, ponieważ mniejsze jest prawdopodobieństwo wyschnięcia żelu. Jak pokazano na rysunku po lewej stronie, membrana jest umieszczona pomiędzy powierzchnią żelu a filtrem. Kanapka transferowa jest tworzona w następujący sposób: podkładka z włókna (gąbka), bibuła filtracyjna, żel, membrana, bibuła filtracyjna, podkładka z włókna (gąbka).
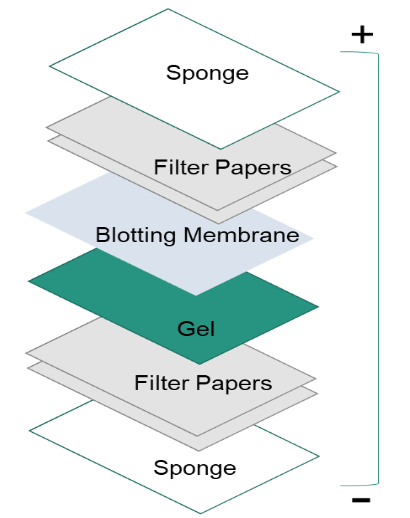 4. Blokowanie.
4. Blokowanie.
Blokowanie jest ważnym krokiem w western blot, aby zapobiec niespecyficznemu wiązaniu się przeciwciał z membraną. Najczęściej stosowanymi typowymi blokerami są BSA i beztłuszczowe suche mleko. Kiedy membrana jest umieszczona w rozcieńczonym roztworze białek, białka przyłączają się do wszystkich miejsc w membranie, do których nie przylgnęły białka docelowe. W ten sposób „szum” w produkcie końcowym western blot może być zmniejszony i skutkować wyraźniejszymi wynikami.
5. Inkubacja przeciwciał.
Po zablokowaniu, przeciwciało pierwotne wiąże się z białkiem docelowym, gdy przeciwciało pierwotne jest inkubowane z membraną. Wybór przeciwciała pierwotnego zależy od antygenu, który ma zostać wykryty. Płukanie membrany roztworem buforowym przeciwciała jest pomocne w minimalizowaniu tła i usuwa niezwiązane przeciwciała. Po wypłukaniu membrany, membrana jest wystawiona na działanie specyficznego przeciwciała wtórnego sprzężonego z enzymem. Podczas inkubacji przeciwciała wtórnego, znakowane przeciwciało wtórne może wiązać się z przeciwciałem pierwotnym, które zareagowało z białkami docelowymi. Na podstawie gatunku przeciwciała pierwotnego, możemy wybrać odpowiednie przeciwciało wtórne.
6) Wykrywanie i wizualizacja białek.
Podłoże reaguje z enzymem, który jest związany z przeciwciałem wtórnym do generowania barwnej substancji. To pozwala nam znać densytometrię i lokalizację białek docelowych. A wielkość przybliżenia są podejmowane przez porównanie pasm białka do markera. Istnieje kilka systemów detekcji dostępnych dla wizualizacji białek, takich jak detekcja kolorymetryczna, detekcja chemiluminescencyjna, detekcja radioaktywna i detekcja fluorescencyjna. System elektrochemiluminescencji (ECL) jest najbardziej powszechną metodą detekcji.
Blot zachodni jest powszechnie stosowany do jakościowego wykrywania białek i modyfikacji potranslacyjnych (np. fosforylacji). Ponadto, może być również stosowany w diagnostyce medycznej, takiej jak test na HIV lub test na BSE.