JOP. Journal of the Pancreas
Słowa kluczowe
Adenocarcinoma, Mucinous; Association; Carcinoma, Intraductal, Noninfiltrating; Pancreatic Neoplasms
INTRODUCTION
Rak koloidalny trzustki, znany również jako lity rak śluzowy lub rak galaretowaty, jest nowotworem wywodzącym się z przewodów trzustkowych i został niedawno uznany za odrębną jednostkę chorobową. Stanowi on jedynie około 1-3% wszystkich raków trzustki. Jego główną cechą morfologiczną jest obecność dobrze odgraniczonych basenów materiału śluzowego, zawierających oderwane komórki nabłonkowe pływające w mucynie .
Rak koloidowy trzustki jest uważany za odrębny podtyp wewnątrzprzewodowego brodawkowatego nowotworu śluzowego (intraductal papillary mucinous neoplasm, IPMN); fakt ten jest ważny, ponieważ może dyktować leczenie chirurgiczne. Diagnostyka różnicowa pomiędzy rakiem koloidalnym a gruczolakorakiem przewodowym jest niezbędna, ponieważ biologiczne i molekularne różnice pomiędzy tymi typami nowotworów powodują bardziej łagodny przebieg kliniczny, lepsze wyniki leczenia chirurgicznego i dłuższe przeżycie w przypadku tych pierwszych.
W niniejszym opisie przypadku przedstawiono charakterystykę kliniczną pacjenta z miejscowo inwazyjnym rakiem koloidalnym trzustki, postępowanie chirurgiczne i wynik leczenia.
Raport przypadku
64-letni mężczyzna, z nadciśnieniem tętniczym i cukrzycą typu 2 w wywiadzie, został przyjęty do naszej poradni z powodu niedokrwistości. W ciągu ostatnich 18 miesięcy skarżył się również na łagodną dyspepsję i bóle w dolnej części pleców. W konwencjonalnych badaniach krwi stwierdzono niedokrwistość mikrocytarną. Markery nowotworowe były prawidłowe, z wyjątkiem CA 19-9 203 U/mL (zakres referencyjny: 0-39 U/mL). W badaniu tomografii komputerowej (CT) jamy brzusznej z kontrastem stwierdzono niejednorodną, nisko zagęszczoną masę o wymiarach 12×7 cm, wywodzącą się z trzonu i ogona trzustki. Masa zajęła tylną ścianę żołądka, zgięcie śledzionowe okrężnicy i śledzionę. Tętnica krezkowa górna i oś celiakii nie były zajęte, jednak tętnica śledzionowa została amputowana u swojego początku (Rycina 1a). Przewód Wirsunga przy głowie trzustki był poszerzony (Rycina 1b), z zakrzepicą żyły śledzionowej, odcinkowym nadciśnieniem wrotnym i żylakami przełyku.
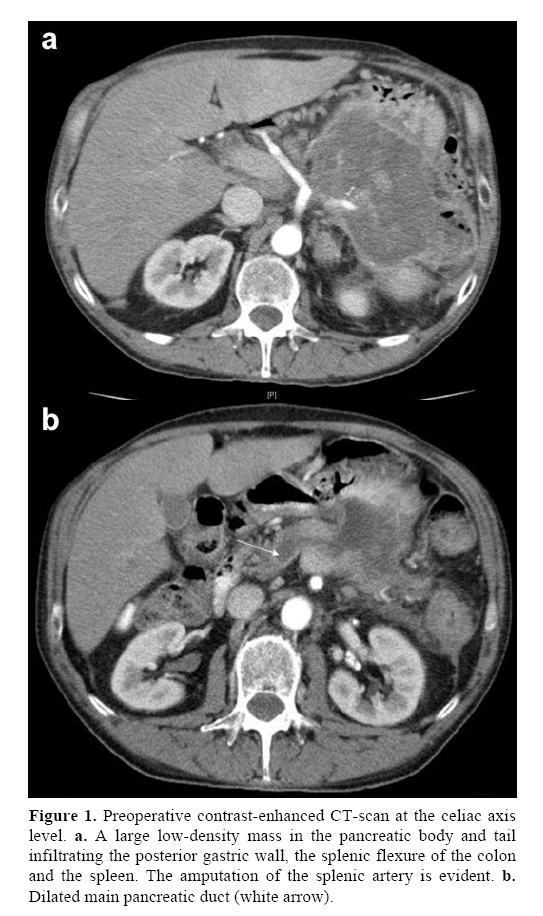
Rycina 1. Przedoperacyjna tomografia komputerowa z kontrastem na poziomie osi celiakii. a. Duża masa o niskiej gęstości w trzonie i ogonie trzustki naciekająca tylną ścianę żołądka, zgięcie śledzionowe okrężnicy i śledzionę. Widoczna jest amputacja tętnicy śledzionowej. b. Poszerzony główny przewód trzustkowy (biała strzałka).
Biopsja aspiracyjna cienkoigłowa ujawniła śluzowaty nowotwór z atypią komórkową sugerującą złośliwość. ERCP nie mogła być wykonana z powodu uchyłka dwunastnicy. W czasie laparotomii stwierdzono dużą masę zaotrzewnową, wnikającą w okoliczne struktury. Wykonano dystalną pankreatektomię ze splenektomią, całkowitą gastrektomię, resekcję fragmentu okrężnicy poprzecznej i płata przepony. Śródoperacyjna biopsja marginesu wycięcia trzustki wykazała dysplazję dużego stopnia w przewodzie Wirsunga, dlatego wykonano pankreatektomię uzupełniającą. Rekonstrukcję wykonano przez esofagojejunostomię Roux-Y i hepaticojejunostomię oraz zespolenie kolokołowe T-T i pierwotne zamknięcie lewej przepony. Przebieg pooperacyjny był bez powikłań, a chory został wypisany w 12. dobie po operacji.
W badaniu patologicznym stwierdzono raka koloidalnego trzustki o średnicy 15 cm, miejscowo naciekającego tylną ścianę żołądka i okrężnicę poprzeczną. Marginesy resekcji zaotrzewnowej były wolne od inwazji. W badaniu mikroskopowym stwierdzono baseny mucyny z rzędami nabłonkowych komórek śluzowatych wykazujących atypię jądrową, a niekiedy przyjmujących wzór gruczołowy (ryc. 2). Zaobserwowano również IPMN z dysplazją wysokiego stopnia (rak in situ) wnikający do całego przewodu Wirsunga. W żadnym z pobranych węzłów chłonnych nie stwierdzono inwazji przerzutów. Po ocenie przez zespół wielodyscyplinarny nie wskazano chemioterapii adiuwantowej.

Rycina 2. Mikroskopowe badanie histopatologiczne wycinka chirurgicznego wykazało charakterystyczne zbiorniki mucyny z rzędami komórek śluzowych nabłonka, wykazujących atypię jądrową i sporadycznie przybierających wzór gruczołowy (H&E; oryginalne powiększenie x10).
W dwuletniej obserwacji tomografia komputerowa nie wykazała wznowy guza, a markery nowotworowe, w tym CA 19- 9, były prawidłowe. Pacjentka pozostaje bezobjawowa i ma doskonałą jakość życia 24 miesiące po zabiegu.
Rozpoznanie
Rak koloidalny trzustki jest rzadkim nowotworem produkującym śluz, który musi być uważany za zróżnicowany typ guza inwazyjnego wśród nowotworów trzustki. Jest to dobrze scharakteryzowany nowotwór w innych narządach, takich jak pierś, prostata czy okrężnica, o zmiennym zachowaniu i rokowaniu w zależności od ustalonych kryteriów rozpoznania w każdym narządzie. W trzustce raki koloidowe zwykle wykazują indolentne zachowanie kliniczne, charakteryzują się powolnym wzrostem i lepszym rokowaniem w porównaniu z gruczolakorakami przewodowymi, dając wskaźnik 5-letniego przeżycia bliski 60% w przypadkach resekcyjnych. Diagnostyka przedoperacyjna ma ogromne znaczenie w prowadzeniu pacjenta: dzięki postępowi w technikach obrazowania, guzy trzustki mogą być wykrywane we wczesnych stadiach i lepiej zdefiniowane w celu zaplanowania dokładnego podejścia chirurgicznego.
Odmienne zachowanie kliniczne ujawnione przez raka koloidowego trzustki może być częściowo związane z dwiema charakterystycznymi cechami tego nowotworu: a) zmienioną polarnością komórek nowotworowych stwierdzoną w badaniu mikroskopowym, gdzie powierzchnia komórek zrębu wykazuje właściwości wydzielnicze zamiast powierzchni komórek przewodowych; oraz b) rodzajem mucyny wydzielanej przez komórki nowotworowe.
Produkcja MUC2 jest wysoce specyficzna w raku koloidowym, podczas gdy MUC1 jest wydzielana w gruczolakoraku. Zarówno MUC1 jak i MUC2 wydają się pełnić ważne role w nowotworach trzustki. MUC1 wydaje się być markerem agresywnego fenotypu i może ułatwiać rozprzestrzenianie się komórek nowotworowych drogą naczyniową. Z drugiej strony, MUC2 ulega powszechnej ekspresji w guzach o łagodnym przebiegu, takich jak niektóre IPMN, a w szczególności w rakach koloidalnych obejmujących różne narządy. Postuluje się, że wydzielanie MUC2 do zrębu prowokuje powstawanie galaretowatej warstwy mucyny wokół komórek nowotworowych, która ogranicza ich przerzutowanie.
Sekcja chirurgiczna, jeśli jest możliwa, jest leczeniem z wyboru w tych nowotworach. Ponieważ rak koloidalny trzustki charakteryzuje się powolnym wzrostem z miejscową inwazją, a nie rozsianą chorobą, radykalne podejście chirurgiczne, dostosowane do wzorca miejscowej inwazji, może być uzasadnione w celu wykonania resekcji R0. Co więcej, nie ma dostępnych danych na temat roli terapii neoadjuwantowej w miejscowo zaawansowanym raku koloidalnym trzustki w celu zmniejszenia obciążenia nowotworowego. Jednakże, jak wspomniano powyżej, resekcja R0 wiąże się z akceptowalnym 5-letnim przeżyciem.
Szczególne rozpoznanie koloidalnego podtypu IPMN może dyktować rozszerzenie pankreatektomii, ponieważ pozostawienie IPMN w pozostałej trzustce może narażać pacjenta na ryzyko nawrotu. U naszej pacjentki wykonano całkowitą pankreatektomię z powodu obecności rozproszonych guzków w resztkowym przewodzie Wirsunga, które histologicznie odpowiadały IPMN o wysokim stopniu dysplazji. Rola terapii adjuwantowej u chorych z rakiem koloidalnym trzustki nie została szczegółowo omówiona. W przypadku resekcji R0, nie ma dowodów klinicznych na to, że terapia adjuwantowa nie poprawi ani przeżycia, ani przeżycia wolnego od choroby .
Podsumowując, rak koloidalny trzustki jest rzadkim podtypem IPMN, który charakteryzuje się łagodnym przebiegiem klinicznym i miejscową inwazją. Preferowane może być radykalne podejście chirurgiczne w celu uzyskania resekcji R0, która może dać 5-letnie przeżycie bliskie 60%. Rozpoznanie inwazyjnego IPMN może decydować o rozszerzeniu zakresu pankreatektomii. The role of adjuvant therapy has not been elucidated.
Konflikt interesów
Autorzy nie mają potencjalnego konfliktu interesów
- Andea A, Klimstra D, Cheng J, et al. Colloid carcinoma of the pancreas. Curr Diagn Pathol. 2004;10:61-68.
- Adsay N, Pierson C, Sarkar F, et al. Colloid (Mucinous Noncystic) carcinoma of the pancreas. Am J Surg Pathol.2001;25:26-42.
- Yopp AC, Katabi N, Janakos M, et al. Invasive Carcinoma Arising in Intraductal Papillary Mucinous Neoplasms of the pancreas. A matched control study with conventional pancreaticductal adenocacinoma. Ann Surg 2011;253:968-974.
- Vo T, Xing Y, Meric-Bernstam F, et al. Long-term outcomes in Patients with mucinous, medullary, tubular, and invasive ductal carcinomas after lumpectomy. Am J Surg. 2007;194:527-531.
- Waters JA, Schnelldorfer T, Aguilar-Saavedra JR, et al. Survival after resection for invasive intraductal papillary mucinous neoplasm and for pancreatic adenocarcinoma: a multi-institutional comparison according to American Joint Committee on Cancer Stage. J Am CollSurg 2011;213:275-283.
- Tanaka M, Chari S, Adsay V, et al. International consensus guidelines for management of intraductal papillary mucinousneoplasms and mucinous cystic neoplasms of the pancreas. Pancreatology. 2006;6:17-32.
- Levi E, Klimstra DS, Andea A, et al. MUC1 and MUC2 inpancreatic neoplasia. J Clin Pathol. 2004;57:456-462.
- Adsay NV, Merati K, Nassar H, et al. Pathogenesis of colloid (pure mucinous) carcinoma of exocrine organs: coupling of gelformingmucin (MUC2) production with altered cell polarity andabnormal cell-stroma interaction may be the key factor in the morphogenesis and indolent behaviour of colloid carcinoma in thebreast and pancreas. Am J Surg Pathol. 2003;27:571-578.
- Schnelldorfer T, Sarr MG, Nagorney DM, et al. Experience with208 resections for intraductal papillary mucinous neoplasm of the pancreas. Arch Surg. 2008;143:639-646.
- Crippa S, Salvia R, Warshaw AL, et al. Mucinous cysticneoplasm of the pancreas is not an aggressive entity: lessons from163 resected patients. Ann Surg. 2008;247:571-579.
- Turrini O, Waters JA, Schnelldorfer T, et al. Invasive intraductal papillary mucinous neoplasm: predictors of survival and role of adjuvant therapy. HBP (Oxford). 2010;12(7):447-455.
.