Mechanizm zwiększania inotropii (siły skurczu serca) przez digoksynę (lanoxin)
Digoksyna (Lanoxin) jest dobrze znanym glikozydem nasercowym i jest stosowana od wielu lat w leczeniu kilku problemów sercowo-naczyniowych, takich jak niewydolność serca i kontrola częstości akcji serca u pacjentów z arytmią przedsionkową, u których występuje szybka odpowiedź komór.1,2 W odniesieniu do niewydolności serca należy zauważyć, że chodzi tu o skurczową niewydolność serca, a nie rozkurczową, w której digoksyna mogłaby potencjalnie pogorszyć ten stan.1 To rozróżnienie jest ważne nie tylko z klinicznego punktu widzenia, ale stanowi kontekst dla przedstawionego pytania.1 W skrócie, pacjenci ze skurczową niewydolnością serca zwykle mają zmniejszony rzut serca (CO). To zmniejszenie CO wynika przede wszystkim z obniżenia objętości wyrzutowej (SV). Objętość wyrzutowa zależy od wielu czynników, takich jak 1) inotropia (siła skurczu komór), 2) obciążenie wstępne (objętość krwi powracającej do serca lub wypełniającej komory podczas rozkurczu) oraz 3) obciążenie następcze (opór dla przepływu krwi do przodu podczas skurczu). Dlatego wszystko, co zwiększa jeden lub więcej z tych czynników, zwiększa SV, a tym samym ostatecznie zwiększa CO (przy założeniu, że tętno nie zmienia się lub wzrasta).
Większość klinicystów uznaje, że rola digoksyny w kontrolowaniu objawów związanych ze skurczową niewydolnością serca wiąże się z jej działaniem inotropowym, czyli zdolnością do zwiększania siły skurczu.3 Niektórzy z tych klinicystów twierdzą, że czyni to poprzez zwiększanie stężenia wapnia wewnątrzkomórkowego (Ca2+). Chociaż to wszystko prawda, prawdziwym pytaniem, które łączy ten proces myślowy, jest to, w jaki sposób digoksyna powoduje wzrost stężenia wapnia w cytozolu i jak to ostatecznie zwiększa inotropię? Aby zrozumieć rolę digoksyny w skurczowej niewydolności serca, klinicysta musi zrozumieć fizjologię cyklu sercowego, który powoduje skurcz komór (systole) i rozkurcz (diastole).
Co dzieje się podczas normalnego skurczu mięśnia sercowego?
Podczas depolaryzacji komór (systole) sód (Na+) przemieszcza się do miocytu serca (podczas fazy 0 potencjału czynnościowego serca; patrz rysunek poniżej). Wkrótce potem potas (K+) zacznie się przemieszczać z miocytu serca do środowiska pozakomórkowego (jest to faza 1 potencjału czynnościowego). W tym czasie cytozolowe stężenie Ca2+ gwałtownie wzrasta na drodze szeregu mechanizmów (faza 2 potencjału czynnościowego).4 Jak pokazano na drugim rysunku, Ca2+ dostaje się do miocytu serca przez napięciowe kanały Ca2+ bramkowane napięciem typu L, które znajdują się w tubuli T miocytu (kanał ten nazywany jest również receptorem DHPR = dihydropirydynowym i jest receptorem, dla którego blokery kanałów wapniowych typu „dihydropirydynowego” (tj, diltiazem i werapamil) hamują). Gdy Ca2+ przedostanie się do cytozolu, wiąże się z kalmoduliną i aktywuje kinazę białkową zależną od Ca2+/kalmoduliny (znaną również jako kinaza II łańcucha lekkiego miozyny (MLKII lub CaMKII).5 Gdy MLKII zostanie utworzona, może robić wiele rzeczy, z których jedną jest zwiększanie cytozolowego Ca2+. MLKII robi to za pomocą dwóch mechanizmów: 1) może fosforylować receptory ryanodynowe (RyR) na siateczce sarkoplazmatycznej, co powoduje przemieszczenie Ca2+ z wnętrza siateczki sarkoplazmatycznej do cytozolu (cytoplazmy) i jednocześnie może 2) fosforylować fosfolamban, który umieszcza Ca2+ wewnątrz siateczki sarkoplazmatycznej poprzez Ca2+-ATPazę (SERCA2) podczas spowolnienia, przygotowując go do wypchnięcia przez RyR podczas następnej depolaryzacji serca.6,7 W większości sytuacji te czynniki działają razem, jednakże stymulacja współczulna (jak to ma miejsce w niewydolności serca) może również zwiększyć aktywność fosfolambanu podczas repolaryzacji, wprowadzając w ten sposób więcej Ca2+ do retikulum sarkoplazmatycznego, które jest już gotowe do następnej repolaryzacji lub potencjału czynnościowego. Jest to próba zwiększenia inotropii przez organizm człowieka za pomocą stymulacji współczulnej, szczególnie podczas skurczowej niewydolności lewej komory serca, gdy rzut serca jest upośledzony.
Ten wzrost stężenia cytozolowego Ca2+ pozwala Ca2+ związać się z troponinąC, która przesuwa tropomiozynę, umożliwiając w ten sposób miozynie i aktynie oddziaływanie ze sobą w celu wywołania skurczu (lub skrócenia włókna mięśniowego).8,9 Im większe stężenie cytozolowego Ca2+, tym większy może być ten proces. W momencie repolaryzacji (podczas rozkurczu) proces ten ulega odwróceniu. Wapń powraca do retikulum sarkoplazmatycznego lub może zostać przeniesiony na zewnątrz miocytu za pośrednictwem pompy wymiany Na+/Ca2+, co pozwala na rozluźnienie miocytów serca podczas rozkurczu. Ponadto pompa ATPazy Na+/K+ resetuje potencjał błonowy, wyrzucając 3 jony Na+ z komórki i wprowadzając 2 jony K+ z powrotem do komórki podczas repolaryzacji (faza 3 potencjału czynnościowego).
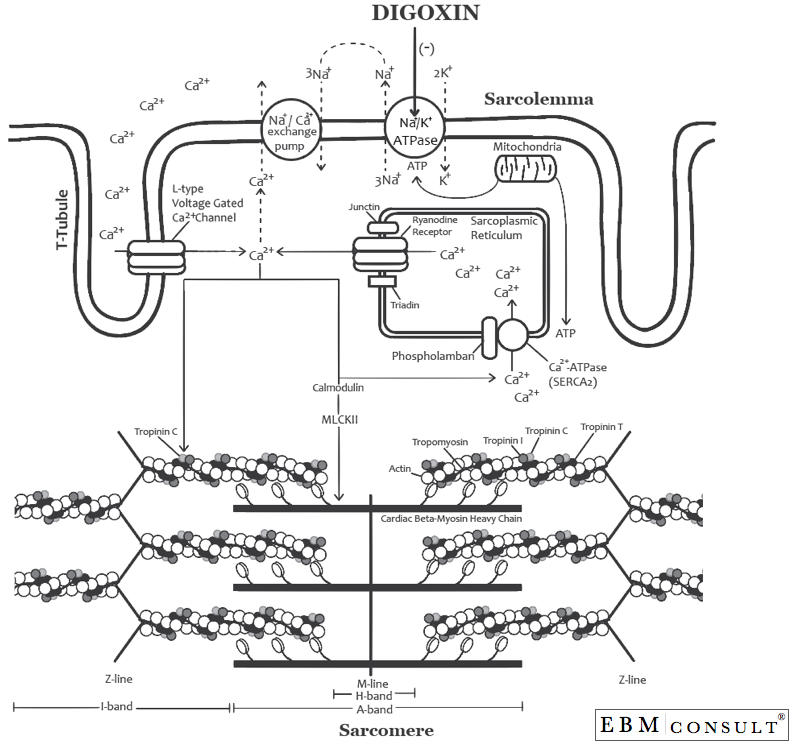
Co się dzieje z tym procesem fizjologicznym, jeśli pacjentowi podano digoksynę?o rozprowadzeniu do serca digoksyna wiąże się z fosforylowaną formą podjednostki alfa pompy ATPazy Na+/K+ i hamuje jej aktywność (patrz rysunek poniżej).10,11 Powoduje to utrzymanie wyższego stężenia wewnątrzkomórkowego lubcytozolowego Na+, co z kolei zaburza gradient Na+ potrzebny do działania pompy wymiany Na+/ Ca2+, ponieważ działa ona poprzez doprowadzenie 3 Na+ z zewnątrz miocytu sercowego do miocytu, a w zamian pobiera Ca2+ z wnętrza miocytu i przenosi go na zewnątrz komórki. Dlatego większe stężenie cytozolowego Ca2+ występuje wewnątrz komórki z digoksyną, co pozwala na większy stopień wiązania z troponiną C i ostatecznie wiązania miozyny/aktyny, co pozwala na większą siłę skurczu (lub inotropię).
Co to oznacza klinicznie (jak to się odnosi do inotropii)?
Niestety nie tak bardzo, jak to brzmi lub byłoby pożądane. Pomimo unikalnego i użytecznego mechanizmu działania u pacjentów z dolnym C, badanie Dig Trial nie wykazało zmniejszenia śmiertelności u pacjentów z niewydolnością serca.12 Wiadomo jednak, że digoksyna zmniejsza objawy i liczbę hospitalizacji związanych z niewydolnością serca, dlatego jest zalecana w skurczowej niewydolności serca w stadium C według wytycznych AHA/ACC.1,12 Wreszcie, należy pamiętać, że ten niewielki korzystny efekt jest widoczny tylko przy stężeniach terapeutycznych. Ponieważ digoksyna ma wąski indeks terapeutyczny, konieczne jest odpowiednie monitorowanie stężenia leku, zwłaszcza u pacjentów z upośledzoną lub zmieniającą się czynnością nerek oraz rozpoczynających stosowanie nowych leków, które są znanymi inhibitorami pompy effluksowej, glikoproteiny P.
- Jessup M, Abraham WT, Casey WT et al. 2009 focused update: ACCF/AHAGuidelines for the Diagnosis and Management of Heart Failure in Adults: a report of the American College of Cardiology Foundation/American HeartAssociation Task Force on Practice Guidelines: developed incollaboration with the International Society for Heart and LungTransplantation. Circulation 2009;119:1977-2016.
- Cheng JW, Rybak I. Use of digoxin for heart failure and atrialfibrillation in elderly patients. Am J Geriatr Pharmacother 2010;8:419-27.
- Little WC, Rossi JR, Freeman GL. Comparison of effects ofdobutamine and ouabain on left ventricular contraction and relaxation in closed-chest dogs. J Clin Invest 1987:80;613-620.
- Zhang L, Kelley J, Schmeisser G et al. Complex formation between junctin, triadin, calsequestrin, and the ryanodine receptor. Proteinof the cardiac junctional sarcoplasmic reticulum membrane. J Biol Chem 1997;272:23389-97.
- Couchonnal LF, Anderson ME. The role of calmodulin kinase II in myocardial physiology and disease. Physiology 2008;23:151-9.
- Lanner JT, Georgiou DK, Joshi AD et al. Ryanodine receptors: structure, expression, molecular details, and function in calciumrelease. Cold Spring Harb Perspect Biol 2010;2:a003996.
- Beard NA, Wei L, Dulhunty AF. Control of muscle ryanodinereceptor calcium release channels by proteins in the sarcoplasmicreticulum lumen. Clin Exp Pharmacol Physiol 2009;36:340-5.
- Kamm KE, Stull JT. Signalling to myosin regulatory light chain in sarcomeres. J Biol Chem 2011;286:9941-7.
- Ding P, Huang J, Battiprolu PK et al. Cardiac myosin light chain kinase is necessary for myosin regulatory light chain phosphorylationand cardiac performance in vivo. J Biol Chem 2010;285:40819-29.
- Li PW, Ho CS, Swaminathan R et al. The chronic effects of long-term digoxin administration on Na+/K(+)-ATPase activity in rattissues. Int J Cardiol 1993;40:95-100.
- Eichhorn EJ, Gheorghiade M. Digoxin. Prog Cardiovasc Dis 2002;44:251-66.
- The Digitalis Investigation Group, The effect of digoxin onmortality and morbidity in patients with heart failure, N Engl J Med 1997;336;525-533.
.