Nagroda Nobla Logo Nagrody Nobla
Angielski
Angielski (pdf)
Szwedzki
![]()
Zgromadzenie Noblowskie przy Karolinska Institutet podjęło dziś decyzję o. przyznać
Nagrodę Nobla 2016 w dziedzinie fizjologii lub medycyny
Yoshinori Ohsumi
za odkrycie mechanizmów autofagii
Podsumowanie
Tegoroczny laureat Nagrody Nobla odkrył i wyjaśnił mechanizmy leżące u podstaw autofagii, fundamentalnego procesu degradacji i recyklingu składników komórkowych.
Słowo autofagia pochodzi od greckich słów auto-, czyli „ja”, i phagein, czyli „jeść”. Tak więc autofagia oznacza „samozjadanie”. Koncepcja ta pojawiła się w latach 60-tych XX wieku, kiedy to badacze po raz pierwszy zaobserwowali, że komórka może niszczyć swoją własną zawartość, zamykając ją w błonach, tworząc woreczkowate pęcherzyki, które są transportowane do przedziału recyklingu, zwanego lizosomem, w celu degradacji. Trudności w badaniu tego zjawiska sprawiły, że niewiele było wiadomo do czasu, gdy w serii błyskotliwych eksperymentów na początku lat 90-tych Yoshinori Ohsumi wykorzystał drożdże piekarskie do zidentyfikowania genów niezbędnych dla autofagii. Następnie objaśnił mechanizmy autofagii u drożdży i wykazał, że podobna skomplikowana maszyneria jest wykorzystywana w naszych komórkach.
Ohsumi doprowadził do nowego paradygmatu w naszym rozumieniu tego, jak komórka przetwarza swoją zawartość. Jego odkrycia otworzyły drogę do zrozumienia fundamentalnego znaczenia autofagii w wielu procesach fizjologicznych, takich jak adaptacja do głodu czy odpowiedź na infekcję. Mutacje w genach autofagii mogą powodować choroby, a proces autofagii jest zaangażowany w kilka schorzeń, w tym nowotwory i choroby neurologiczne.
Degradacja – centralna funkcja we wszystkich żywych komórkach
W połowie lat 50-tych naukowcy zaobserwowali nowy wyspecjalizowany przedział komórkowy, zwany organellą, zawierający enzymy trawiące białka, węglowodany i lipidy. Ten wyspecjalizowany przedział jest określany jako „lizosom” i funkcjonuje jako stacja robocza do degradacji składników komórkowych. Belgijski naukowiec Christian de Duve otrzymał w 1974 roku Nagrodę Nobla w dziedzinie fizjologii lub medycyny za odkrycie lizosomu. Nowe obserwacje poczynione w latach 60-tych wykazały, że wewnątrz lizosomów można czasem znaleźć duże ilości zawartości komórkowej, a nawet całe organelle. Wydawało się więc, że komórka posiada strategię dostarczania dużych ładunków do lizosomu. Dalsze analizy biochemiczne i mikroskopowe ujawniły nowy typ pęcherzyków transportujących ładunek komórkowy do lizosomu w celu jego degradacji (Rysunek 1). Christian de Duve, naukowiec stojący za odkryciem lizosomu, ukuł termin autofagia, „samozjadanie”, aby opisać ten proces. Nowe pęcherzyki zostały nazwane autofagosomami.
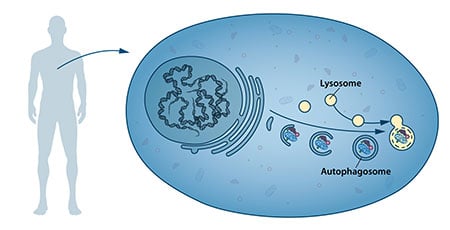
W latach 70-tych i 80-tych XX wieku badacze skupili się na wyjaśnieniu innego systemu służącego do degradacji białek, a mianowicie „proteasomu”. W ramach tego obszaru badawczego Aaron Ciechanover, Avram Hershko i Irwin Rose otrzymali w 2004 roku Nagrodę Nobla w dziedzinie chemii za „odkrycie degradacji białek z udziałem ubikwityny”. Proteasom skutecznie degraduje białka jedno po drugim, ale ten mechanizm nie wyjaśniał, w jaki sposób komórka pozbywa się większych kompleksów białkowych i zużytych organelli. Czy odpowiedzią może być proces autofagii, a jeśli tak, to jakie są jego mechanizmy?
Przełomowy eksperyment
Yoshinori Ohsumi był aktywny w różnych obszarach badawczych, ale po założeniu własnego laboratorium w 1988 roku skupił swoje wysiłki na degradacji białek w wakuoli, organelli, która odpowiada lizosomowi w komórkach ludzkich. Komórki drożdży są stosunkowo łatwe do badania i dlatego często wykorzystuje się je jako model dla komórek ludzkich. Są one szczególnie przydatne do identyfikacji genów, które są ważne w złożonych szlakach komórkowych. Ohsumi stanął jednak przed poważnym wyzwaniem: komórki drożdży są małe, a ich wewnętrzne struktury nie dają się łatwo odróżnić pod mikroskopem, dlatego nie był pewien, czy autofagia w ogóle istnieje w tym organizmie. Ohsumi uznał, że jeśli uda mu się zakłócić proces degradacji w wakuoli, podczas gdy proces autofagii jest aktywny, to autofagosomy powinny gromadzić się w wakuoli i stać się widoczne pod mikroskopem. Wyhodował więc zmutowane drożdże pozbawione enzymów rozkładu wakuolarnego i jednocześnie stymulował autofagię poprzez głodzenie komórek. Rezultaty były uderzające! W ciągu kilku godzin wakuole wypełniły się małymi pęcherzykami, które nie uległy degradacji (Rysunek 2). Pęcherzyki te były autofagosomami, a eksperyment Ohsumiego dowiódł, że autofagia istnieje w komórkach drożdży. Ale co ważniejsze, miał on teraz metodę identyfikacji i charakterystyki kluczowych genów zaangażowanych w ten proces. Był to wielki przełom, a Ohsumi opublikował wyniki w 1992 roku.

Odkryto geny autofagii
Ohsumi wykorzystał teraz swoje zmodyfikowane szczepy drożdży, w których autofagosomy gromadziły się podczas głodówki. Takie nagromadzenie nie powinno mieć miejsca, jeśli geny ważne dla autofagii zostałyby unieczynnione. Ohsumi poddał komórki drożdży działaniu substancji chemicznej, która losowo wprowadziła mutacje w wielu genach, a następnie wywołał autofagię. Jego strategia zadziałała! W ciągu roku od odkrycia autofagii u drożdży, Ohsumi zidentyfikował pierwsze geny niezbędne dla autofagii. W późniejszej serii eleganckich badań, białka kodowane przez te geny zostały funkcjonalnie scharakteryzowane. Wyniki pokazały, że autofagia jest kontrolowana przez kaskadę białek i kompleksów białkowych, z których każdy reguluje odrębny etap inicjacji i powstawania autofagów (Rysunek 3).
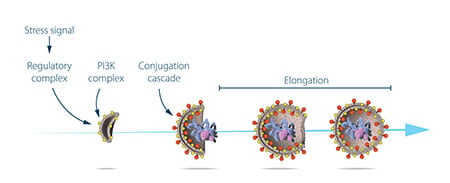
Autofagia – istotny mechanizm w naszych komórkach
Po zidentyfikowaniu mechanizmów autofagii u drożdży pozostało kluczowe pytanie. Czy istniał analogiczny mechanizm kontrolujący ten proces u innych organizmów? Wkrótce stało się jasne, że praktycznie identyczne mechanizmy działają w naszych własnych komórkach. Narzędzia badawcze niezbędne do zbadania znaczenia autofagii u ludzi były już dostępne.
Dzięki Ohsumiemu i innym, którzy poszli w jego ślady, wiemy obecnie, że autofagia kontroluje ważne funkcje fizjologiczne, w których składniki komórkowe muszą być degradowane i poddawane recyklingowi. Autofagia może szybko dostarczyć paliwa energetycznego i budulca do odnowy składników komórkowych, dlatego jest niezbędna w odpowiedzi komórkowej na głód i inne rodzaje stresu. Po infekcji, autofagia może wyeliminować inwazyjne wewnątrzkomórkowe bakterie i wirusy. Autofagia przyczynia się do rozwoju embrionu i różnicowania komórek. Komórki wykorzystują również autofagię do eliminacji uszkodzonych białek i organelli, mechanizm kontroli jakości, który jest krytyczny dla przeciwdziałania negatywnym skutkom starzenia się.
Zaburzona autofagia została powiązana z chorobą Parkinsona, cukrzycą typu 2 i innymi zaburzeniami, które pojawiają się u osób starszych. Mutacje w genach autofagii mogą powodować choroby genetyczne. Zaburzenia w funkcjonowaniu maszynerii autofagicznej są również związane z nowotworami. Obecnie trwają intensywne badania nad opracowaniem leków, które mogą być ukierunkowane na autofagię w różnych chorobach.
Autofagia jest znana od ponad 50 lat, ale jej fundamentalne znaczenie w fizjologii i medycynie zostało docenione dopiero po badaniach Yoshinori Ohsumi, które zmieniły paradygmat w latach 90. Za swoje odkrycia otrzymał on tegoroczną Nagrodę Nobla w dziedzinie fizjologii lub medycyny.
Kluczowe publikacje
Takeshige, K., Baba, M., Tsuboi, S., Noda, T. and Ohsumi, Y. (1992). Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. Journal of Cell Biology 119, 301-311
Tsukada, M. and Ohsumi, Y. (1993). Isolation and characterization of autophagy-defective mutants of Saccharomyces cervisiae. FEBS Letters 333, 169-174
Mizushima, N., Noda, T., Yoshimori, T., Tanaka, Y., Ishii, T., George, M.D., Klionsky, D.J., Ohsumi, M. and Ohsumi, Y. (1998). A protein conjugation system essential for autophagy. Nature 395, 395-398
Ichimura, Y., Kirisako T., Takao, T., Satomi, Y., Shimonishi, Y., Ishihara, N., Mizushima, N., Tanida, I., Kominami, E., Ohsumi, M., Noda, T. and Ohsumi, Y. (2000). A ubiquitin-like system mediates protein lipidation. Nature, 408, 488-492
Yoshinori Ohsumi urodził się w 1945 roku w Fukuoka, Japonia. Tytuł doktora uzyskał na Uniwersytecie Tokijskim w 1974 roku. Po trzech latach spędzonych na Uniwersytecie Rockefellera w Nowym Jorku, USA, powrócił na Uniwersytet Tokijski, gdzie w 1988 roku założył swoją grupę badawczą. Od 2009 roku jest profesorem w Tokyo Institute of Technology.
Zespół Noblowski, składający się z 50 profesorów Karolinska Institutet, przyznaje Nagrodę Nobla w dziedzinie fizjologii lub medycyny. Komitet Noblowski ocenia nominacje. Od 1901 r. Nagroda Nobla jest przyznawana naukowcom, którzy dokonali najważniejszych odkryć dla dobra ludzkości.
Nagroda Nobla® jest zastrzeżonym znakiem towarowym Fundacji Noblowskiej
Powrót do początku strony