Nosokomialne zapalenie płuc
(Ten rozdział został przedrukowany za zgodą z Williams MV, Hayward R: Comprehensive Hospital Medicine, 1st edition. Philadelphia, WB Saunders, in press.)
Tło
Nosokomialne zapalenie płuc (NP) jest główną przyczyną śmiertelności wśród pacjentów, którzy umierają z powodu zakażeń szpitalnych. Definiowane jako zapalenie płuc występujące 48 lub więcej godzin po przyjęciu do szpitala, NP obejmuje również podgrupę zapalenia płuc związanego z wentylacją (VAP), definiowaną jako zapalenie płuc rozwijające się 48 do 72 godzin po rozpoczęciu wentylacji mechanicznej. Częstość występowania NP wynosi od 5 do 15 przypadków na 1000 przyjęć do szpitala. Zapalenie płuc związane z opieką zdrowotną (Healthcare-associated pneumonia – HCAP), stanowiące część kontinuum NP, opisuje coraz częstszy odsetek zapaleń płuc rozwijających się poza szpitalem (Tabela I) (1). Pacjenci ci, zwykle przebywający w domach opieki lub domach pomocy społecznej, są narażeni na zakażenie drobnoustrojami opornymi na antybiotyki i powinni być traktowani podobnie jak w przypadku szpitalnego zapalenia płuc, a nie środowiskowego zapalenia płuc. Większość danych, na podstawie których podejmujemy decyzje diagnostyczne i terapeutyczne dotyczące NP, pochodzi z badań przeprowadzonych u pacjentów wentylowanych mechanicznie i jest ekstrapolowana w celu sformułowania zaleceń dla pacjentów niewentylowanych.
Śmiertelność przypisywana NP jest przedmiotem dyskusji, ale może wynosić nawet 30%. Obecność szpitalnego zapalenia płuc wydłuża czas pobytu w szpitalu średnio o 7-10 dni, a w przypadku VAP, szacuje się, że koszt jednego przypadku wynosi od 10 000 do 40 000 USD (2).
Ocena
Prezentacja kliniczna
Objawy i symptomy
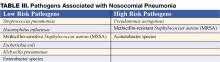
Nosokomialne zapalenie płuc jest zwykle rozpoznawane na podstawie obrazu klinicznego. Typowe objawy i oznaki obejmują gorączkę, kaszel z plwociną i duszność w połączeniu z niedotlenieniem i nowym naciekiem na zdjęciu radiologicznym klatki piersiowej (CXR). U osób starszych objawy mogą być bardziej subtelne, a delirium, gorączka lub leukocytoza przy braku kaszlu powinny skłonić do rozważenia tej choroby. Prawdopodobieństwo wystąpienia NP wzrasta wśród pacjentów z czynnikami ryzyka mikroaspiracji, kolonizacji jamy ustno-gardłowej lub nadmiernego wzrostu opornych organizmów (Tabela II) (3).
Diagnoza różnicowa
Przed ustaleniem rozpoznania NP należy rozważyć alternatywne przyczyny gorączki, hipoksji i nacieków płucnych. Najczęściej są to zatorowość płucna, obrzęk płuc lub niedodma. Alternatywne źródła zakażeń, takie jak zakażenia dróg moczowych, skóry i tkanek miękkich oraz zakażenia związane z urządzeniami (np. centralne cewniki żylne) są częste u hospitalizowanych pacjentów i powinny być wykluczone przed rozpoznaniem szpitalnego zapalenia płuc.
 click for large version
click for large version
click for large version
Diagnostyka
Strategie diagnostyczne w przypadku NP mają na celu potwierdzenie rozpoznania i identyfikację patogenu etiologicznego, co pozwala na szybką, skuteczną i sprawną antybiotykoterapię. Niestety, nie ma zgodności co do najlepszego podejścia do diagnostyki szpitalnego zapalenia płuc. Po uzyskaniu pełnej morfologii krwi i wykonaniu posiewów krwi, można wybrać pomiędzy klinicznym i mikrobiologicznym podejściem do diagnostyki. Diagnoza kliniczna opiera się na nowym lub postępującym nacieku radiologicznym wraz z objawami infekcji, takimi jak gorączka, leukocytoza lub ropna plwocina. Diagnoza kliniczna jest czuła, ale może prowadzić do nadużywania antybiotyków. Podejście mikrobiologiczne wymaga pobierania próbek wydzielin z dróg oddechowych i może zmniejszyć niewłaściwe stosowanie antybiotyków, ale trwa dłużej i może nie być dostępne we wszystkich szpitalach.
Preferowane badania
Podejście mikrobiologiczne do diagnostyki polega na wykorzystaniu ilościowych lub półilościowych hodowli w celu stworzenia progów dla leczenia antybiotykami. Posiewy bakteryjne, które wykazują poziom wzrostu powyżej progów opisanych poniżej, uzasadniają leczenie, podczas gdy te poniżej powinny spowodować wstrzymanie lub zaprzestanie podawania antybiotyków.
Podejście bronchoskopowe: Płukanie oskrzelowo-pęcherzykowe (BAL) z wartością graniczną 10 (4) organizmów/mL lub pędzelek do pobierania próbek (PSB) z wartością graniczną 10 (3) organizmów/mL są uważane za najbardziej specyficzne testy diagnostyczne, gdy są wykonywane przed rozpoczęciem antybiotykoterapii lub przed zmianą antybiotyków, jeśli pacjent już je otrzymuje. U pacjentów stabilnych klinicznie, antybiotyki mogą być bezpiecznie odstawione, jeśli wzrost bakterii spadnie poniżej wartości progowych. Jeśli posiewy są dodatnie, antybiotykoterapia powinna być dostosowana do zidentyfikowanego drobnoustroju. Podejście bronchoskopowe jest preferowane u pacjentów wentylowanych mechanicznie, u których zapalenie płuc rozwija się późno w trakcie pobytu w szpitalu (>5-7 dni), u których istnieje ryzyko wystąpienia nietypowych patogenów, u których nie powiodło się leczenie lub u których podejrzewa się inne rozpoznanie.
Podejście nie bronchoskopowe: Wykazano, że jakościowe aspiraty dotchawicze (ETA) są dość czułe u wentylowanych pacjentów, regularnie identyfikują organizmy, które mogą być następnie wykryte przez BAL lub PSB, a jeśli wynik jest negatywny, powinny skutkować wstrzymaniem antybiotyków. Ilościowa aspiracja dotchawicza z punktem odcięcia 10 (6) organizmów/ml jest często zalecana w celu zmniejszenia nadużywania antybiotyków, ale wyniki powinny być interpretowane ostrożnie, ponieważ ich czułość i swoistość wynosi tylko około 75% (1). Należy rozważyć wstrzymanie podawania antybiotyków u stabilnego klinicznie pacjenta z ujemnym wynikiem ETA, jeśli antybiotyki nie były zmieniane w ciągu ostatnich 72 godzin. Na wielu oddziałach intensywnej terapii zaczęto pobierać próbki wydzieliny z dolnych dróg oddechowych za pomocą cewników ssących (blind PSB, blind mini-BAL). Techniki te mogą być wykonywane o każdej porze przez przeszkolonych terapeutów oddechowych lub pielęgniarki, dostarczają danych hodowlanych podobnych do tych z bronchoskopii, mogą być bezpieczniejsze i mniej kosztowne niż bronchoskopia. Ogólnie rzecz biorąc, techniki nie bronchoskopowe są preferowane u pacjentów, którzy nie są wentylowani mechanicznie. Pobieranie próbek plwociny, choć łatwe do uzyskania, nie zostało dobrze przebadane w NP. Jednak u pacjentów, u których nie można zastosować bronchoskopii lub innych technik niebronchoskopowych, można pobierać plwocinę w celu identyfikacji potencjalnie opornych drobnoustrojów i dostosowania terapii.
Opcje alternatywne
Clinical Pulmonary Infection Score – połączenie podejścia klinicznego i mikrobiologicznego
Kliniczne rozpoznanie szpitalnego zapalenia płuc (nowy naciek + gorączka, leukocytoza lub ropna plwocina) prawdopodobnie prowadzi do nadużywania antybiotyków, ale dążenie do rozpoznania bronchoskopowego jest inwazyjne, kosztowne i wymaga wiedzy technicznej. Ilościowa ETA, ślepe PSB i ślepe BAL omówione powyżej są przykładami pewnych kompromisów, które pozwalają uniknąć konieczności bronchoskopii, ale dodają dane mikrobiologiczne, próbując zapobiec nadmiernej antybiotykoterapii. Formalne łączenie metod diagnostycznych (kliniczna + mikrobiologiczna) może być również przydatne. Jedną z takich opcji jest zastosowanie skali CPIS (clinical pulmonary infection score), która łączy dane kliniczne, radiograficzne, fizjologiczne i mikrobiologiczne w wynik liczbowy. Wykazano, że wyniki >6 dobrze korelują z ilościowym BAL (4). Nowsze badania sugerują jednak niższą specyficzność, co może nadal prowadzić do nadużywania antybiotyków, ale to podejście pozostaje bardziej dokładne niż ogólne podejście kliniczne. Użycie CPIS seryjnie w momencie podejrzenia NP i ponownie po 72 godzinach może być bardziej użyteczne. U pacjentów z początkowym niskim klinicznym podejrzeniem zapalenia płuc (CPIS 6 lub mniej) można bezpiecznie odstawić antybiotyki po 72 godzinach, jeśli CPIS pozostaje niski (5). Taka strategia może być przydatna w warunkach, w których bardziej zaawansowane metody diagnostyczne nie są dostępne.
Wielokrotne badania biologicznych markerów infekcji próbowały znaleźć nieinwazyjny, szybki i dokładny sposób określenia, kto potrzebuje antybiotyków z powodu domniemanego NP. Niestety, wyniki były w dużej mierze rozczarowujące. Ostatnio wykazano, że pomiar rozpuszczalnego receptora wyzwalającego wyrażonego na komórkach mieloidalnych (sTREM-1), który jest podwyższony w warunkach infekcji, może poprawić naszą zdolność do dokładnego diagnozowania NP. Pomiar sTREM-1 był w 98% czuły i w 90% specyficzny dla rozpoznania zapalenia płuc u pacjentów wentylowanych mechanicznie (6). Chociaż jest to obiecujące, potrzeba więcej danych, zanim test ten będzie mógł być zalecany do rutynowego stosowania.
Pielęgnacja
Wczesne rozpoczęcie odpowiedniej empirycznej antybiotykoterapii
Wczesne rozpoczęcie odpowiedniej empirycznej antybiotykoterapii (tzn. podawane antybiotyki są aktywne wobec wszystkich wyizolowanych organizmów) wiąże się z poprawą przeżywalności w porównaniu z początkową nieodpowiednią terapią (1,7). Antybiotykoterapię należy rozpocząć natychmiast po pobraniu próbek krwi i plwociny na posiew i nie należy jej wstrzymywać w przypadku opóźnienia w badaniach diagnostycznych. Konieczność szybkiego i sprawnego wyboru antybiotyków skłania do stosowania antybiotyków o szerokim spektrum działania. W celu uniknięcia niepotrzebnego nadużywania antybiotyków o szerokim spektrum działania, terapia powinna być oparta na ryzyku występowania patogenów wielolekoopornych (MDR). Identyfikacja pacjentów z niskim ryzykiem wystąpienia patogenów MDR na podstawie kryteriów klinicznych pozwala na zastosowanie węższej, ale skutecznej antybiotykoterapii. Do pacjentów niskiego ryzyka należą ci, u których zapalenie płuc rozwija się we wczesnym okresie hospitalizacji (< 5-7 dni), nie mają obniżonej odporności, nie byli wcześniej leczeni antybiotykami o szerokim spektrum działania i nie występują u nich czynniki ryzyka HCAP (Tabela I) (1,7). U tych pacjentów antybiotyki powinny być ukierunkowane na powszechnie występujące drobnoustroje nabyte w środowisku (Tabela III – patogeny niskiego ryzyka). Odpowiednia początkowa antybiotykoterapia może obejmować cefalosporyny trzeciej generacji lub inhibitory beta-laktamów/beta-laktamazy. W niektórych społecznościach lub oddziałach szpitalnych częstość występowania oporności na metycylinę wśród izolatów Staphylococcus aureus (MRSA) może być wystarczająco wysoka, aby uzasadnić wstępną terapię empiryczną wankomycyną lub linezolidem.
 kliknij aby powiększyć
kliknij aby powiększyć
click for large version
Niestety, obecnie coraz bardziej złożeni pacjenci hospitalizowani raczej nie należą do grupy „niskiego ryzyka”, zwłaszcza na oddziałach intensywnej terapii.
Pacjenci, którzy nie spełniają kryteriów niskiego ryzyka, są uważani za pacjentów wysokiego ryzyka dla patogenów MDR (Tabela III – patogeny wysokiego ryzyka). Początkowa terapia empiryczna musi być szeroka i powinna obejmować jeden lek przeciwpseudomonalny (cefepim lub imipenem lub inhibitor beta-laktamów/beta-laktamazy) plus fluorochinolon lub aminoglikozyd plus wankomycynę lub linezolid. Specyficzna początkowa terapia empiryczna powinna być podyktowana lokalnymi wzorcami oporności, kosztami i dostępnością preferowanych środków. Kiedy rozpoczyna się terapię o tak szerokim spektrum, konieczne staje się zastosowanie „deeskalacji” antybiotyków, aby ograniczyć ich nadużywanie. Terapia deeskalacyjna koncentruje się na zawężaniu spektrum antybiotyków na podstawie wyników hodowli i ograniczaniu całkowitego czasu trwania terapii. Hospitalista powinien dążyć do osiągnięcia takiej deeskalacji w ciągu 48-72 godzin od rozpoczęcia podawania antybiotyków o szerokim spektrum działania.
 kliknij, aby powiększyć
kliknij, aby powiększyć
kliknij, aby powiększyć
Późniejsze leczenie
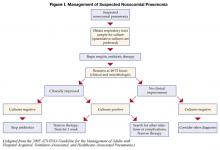
Pacjenci, u których rozpoczęto wstępną empiryczną antybiotykoterapię z powodu podejrzenia szpitalnego zapalenia płuc, powinni zostać poddani ponownej ocenie w ciągu 48-72 godzin. W szczególności należy sprawdzić posiewy i ocenić odpowiedź kliniczną na leczenie. Rycina I opisuje algorytm kierowania leczeniem (1). U pacjentów, którzy są stabilni klinicznie i mają ujemne posiewy z dolnych dróg oddechowych, antybiotyki mogą być odstawione. Pacjenci z dodatnimi posiewami powinni mieć antybiotyki dostosowane lub „deeskalowane” w oparciu o zidentyfikowane organizmy. Ogólnie rzecz biorąc, należy stosować antybiotyk o najwęższym spektrum działania, który jest aktywny wobec wyizolowanych bakterii. Stosowanie terapii skojarzonej w przypadku drobnoustrojów gram ujemnych (dwa lub więcej antybiotyków aktywnych wobec jednego izolatu bakterii) jest szeroko praktykowane w celu osiągnięcia synergii lub zapobieżenia rozwojowi oporności. Jednak w przypadku braku neutropenii nie wykazano przewagi terapii skojarzonej nad monoterapią (8) i preferowana jest monoterapia. Izolacja MRSA z próbki z układu oddechowego również powinna skutkować zastosowaniem monoterapii. W niektórych badaniach sugerowano, że linezolid może mieć przewagę nad wankomycyną w leczeniu zapalenia płuc wywołanego przez MRSA, jednak wniosek ten wymaga potwierdzenia w badaniach prospektywnych.
Drugim elementem deeskalacji jest skrócenie całkowitego czasu trwania terapii. CPIS może być wykorzystany do skrócenia czasu trwania terapii u chorych z niskim ryzykiem zapalenia płuc. Badacze z centrum medycznego Veterans Affairs randomizowali pacjentów, u których podejrzewano NP, ale którzy mieli wynik CPIS < 6, do leczenia przez 10-21 dni lub do terapii krótkoterminowej. Pacjenci otrzymujący krótkotrwałą terapię byli ponownie oceniani w 3. dniu i jeśli ich wynik CPIS pozostawał < 6, antybiotyki były zatrzymywane (5). Grupa stosująca terapię krótkoterminową nie miała różnicy w śmiertelności w porównaniu z grupą stosującą leczenie standardowe, ale zużywała mniej antybiotyków, krócej przebywała na oddziale intensywnej terapii i była mniej narażona na wystąpienie superinfekcji lub zakażenia drobnoustrojem opornym. Jeśli nie stosuje się CPIS lub jeśli uważa się, że pacjenci są w grupie podwyższonego ryzyka lub przekonująco wykazano, że mają NP, nadal można preferować krótszy kurs terapii. W dużym randomizowanym badaniu wykazano, że 8-dniowa antybiotykoterapia pacjentów z VAP daje podobne wyniki kliniczne w porównaniu z 15-dniową terapią. Dodatkowo, krótsza antybiotykoterapia wiązała się z mniejszym prawdopodobieństwem rozwoju kolejnych zakażeń patogenami wieloopornymi. W podgrupie pacjentów w grupie leczonej 8-dniową antybiotykoterapią, zakażonych niefermentującymi pałeczkami Gram ujemnymi (np. Pseudomonas aeruginosa), odnotowano wyższy wskaźnik nawrotów infekcji płucnej, ale dzięki agresywnemu nadzorowi nie przekładało się to na wyższe ryzyko śmiertelności w tej podgrupie pacjentów (9).
Podsumowując, leczenie pacjentów z podejrzeniem NP rozpoczyna się od natychmiastowego rozpoczęcia antybiotykoterapii i pobrania wydzieliny z dróg oddechowych. Podczas gdy pacjenci niskiego ryzyka mogą otrzymać terapię o węższym spektrum, większość pacjentów będzie wymagała szerokiej wstępnej terapii empirycznej. Schemat antybiotykoterapii powinien być jednak zawężony w ciągu 48-72 godzin w oparciu o wyniki mikrobiologiczne, jeśli stan pacjenta ulega poprawie. Całkowity czas trwania leczenia wynoszący 1 tydzień jest bezpieczny i skuteczny, z mniejszą szansą na rozwój organizmów opornych. W podgrupie pacjentów z zakażeniami rzekomokomórkowymi, po leczeniu trwającym 1 tydzień należy prowadzić aktywną obserwację w kierunku nawrotów lub alternatywnie leczenie można przedłużyć do 2 tygodni.
Prognoza
Po rozpoczęciu leczenia ZN poprawę stanu klinicznego obserwuje się zwykle w ciągu 48-72 godzin. Istnieje niewiele dowodów na to, że należy śledzić odpowiedź mikrobiologiczną (usunięcie dodatnich posiewów) lub odpowiedź na podstawie radiografii klatki piersiowej. Radiogram klatki piersiowej często nie nadąża za odpowiedzią kliniczną, jednak wyraźne pogorszenie obrazu CXR (>50% wzrost nacieku) w ciągu pierwszych 48 godzin może wskazywać na niepowodzenie leczenia. Rozwiązanie kliniczne mierzone temperaturą, liczbą białych krwinek i utlenowaniem krwi następuje zwykle po 6-7 dniach (10). Wykazano, że brak poprawy oksygenacji do 72 godzin jest czynnikiem predykcyjnym niepowodzenia leczenia.
Ogólna śmiertelność wśród pacjentów z NP wynosi aż 30-70%, głównie z powodu poważnych chorób współistniejących w populacji ryzyka. Wyższe wskaźniki śmiertelności obserwuje się u pacjentów z VAP i opornymi drobnoustrojami. Śmiertelność przypisywana epizodowi NP wynosi około 30% i może być zredukowana do <15% przy zastosowaniu odpowiedniej antybiotykoterapii (1).
Prewencja
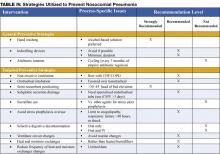
Strategie prewencyjne są albo ukierunkowane na zmniejszenie ogólnej częstości występowania powikłań infekcyjnych u hospitalizowanych pacjentów, albo są specjalnie ukierunkowane na zmniejszenie częstości występowania szpitalnego zapalenia płuc (3). Większość danych wspierających strategie prewencyjne jest ograniczona do pacjentów przebywających na OIT, a w szczególności pacjentów poddawanych wentylacji mechanicznej. Jednakże wiele z zasad profilaktyki można ekstrapolować na populację spoza OIT. Strategie prewencyjne przedstawiono w tabeli IV (strona 18).
Ogólne strategie prewencyjne
Ogólne strategie prewencyjne mają na celu uniknięcie zakażenia pacjentów drobnoustrojami opornymi na środki przeciwdrobnoustrojowe, które występują w szpitalach, lub złagodzenie powstawania drobnoustrojów opornych na środki przeciwdrobnoustrojowe. Zapobieganie jatrogennemu rozprzestrzenianiu się opornych organizmów zależy od starannej higieny rąk. Mycie rąk przed i po kontakcie z pacjentem zmniejsza częstość występowania zakażeń szpitalnych. Płuczki do rąk na bazie alkoholu, umieszczone przy łóżku chorego, mogą być lepsze od wody z mydłem, a ponadto poprawiają przestrzeganie zasad higieny rąk.
Minimalizacja stosowania urządzeń wewnątrzoponowych (linii centralnych, cewników moczowych) również zmniejsza częstość pojawiania się opornych drobnoustrojów. Jeśli te urządzenia są niezbędne, należy skupić się na ich terminowym usunięciu. Kontrola stosowania antybiotyków jest kluczowym elementem wielu strategii profilaktycznych. Przedłużone lub niepotrzebne stosowanie antybiotyków o szerokim spektrum działania jest silnie związane z rozwojem i kolonizacją organizmów opornych. Strategie, które koncentrują się na agresywnej deeskalacji antybiotyków (opisane powyżej) są kluczowym narzędziem prewencyjnym. Niektóre instytucje odniosły sukces dzięki ograniczeniu lub rotacji antybiotyków, ale brakuje długoterminowych danych na temat skuteczności tych technik.
 kliknij, aby powiększyć
kliknij, aby powiększyć
kliknij, aby powiększyć
Ukierunkowane strategie profilaktyczne
.
Strategie profilaktyczne mające na celu obniżenie częstości występowania NP koncentrują się na zmniejszeniu czynników ryzyka kolonizacji jamy ustno-gardłowej lub żołądka, a następnie aspiracji zanieczyszczonej wydzieliny z jamy ustno-gardłowej lub żołądka (1,3,7,11).
Intubacja dotchawicza jest jednym z najważniejszych czynników ryzyka NP u chorych wymagających wsparcia wentylacyjnego. Zastosowanie wentylacji nieinwazyjnej (NIV) lub wentylacji przez maskę z dodatnim ciśnieniem w wybranych grupach chorych skutecznie zapobiega szpitalnemu zapaleniu płuc. Wentylacja nieinwazyjna okazała się najbardziej skuteczna u pacjentów z ostrymi zaostrzeniami przewlekłej obturacyjnej choroby płuc (POChP) i obrzękiem płuc wtórnym do zastoinowej niewydolności serca (CHF) i powinna być rozważana u odpowiednio dobranych chorych. Jeśli konieczna jest intubacja, należy unikać intubacji nosowo-tchawiczej ze względu na większą częstość występowania NP w porównaniu z intubacją dotchawiczą.
Ułożenie w pozycji leżącej może przyczyniać się do rozwoju NP, prawdopodobnie z powodu zwiększonego ryzyka refluksu żołądkowego i następowej aspiracji. Badania nad pozycją półleżącą (uniesienie wezgłowia łóżka > 45 stopni) wykazały mniejszy refluks, mniejszą aspirację, a w jednym z ostatnich randomizowanych badań kontrolnych znaczące zmniejszenie częstości występowania VAP (12). Podniesienie wezgłowia łóżka jest wyraźnie wskazane u pacjentów wentylowanych mechanicznie i prawdopodobnie przyniesie korzyści wszystkim pacjentom z ryzykiem aspiracji i następowego NP, chociaż technika ta nie została dobrze zbadana u pacjentów niewentylowanych.
Drenaż wydzieliny podgłośniowej (SSD) polega na usunięciu zgromadzonej wydzieliny powyżej mankietu specjalistycznej rurki intubacyjnej, która w przeciwnym razie mogłaby wyciekać do płuc. Metaanaliza pięciu badań oceniających tę nową technologię wykazała znaczące zmniejszenie częstości występowania VAP. Należy rozważyć zastosowanie SSD u chorych wymagających ponad 3-dniowej wentylacji mechanicznej (13).
Leki stosowane w profilaktyce wrzodu trawiennego, które zwiększają pH żołądka – takie jak antagoniści H2 i leki zobojętniające – umożliwiają kolonizację górnego odcinka przewodu pokarmowego przez potencjalnie patogenne drobnoustroje i w związku z tym zwiększają ryzyko wystąpienia NP. Uważa się, że stosowanie sukralfatu zamiast antagonistów H2 prowadzi do mniejszej alkalizacji żołądka i mniejszego przerostu bakteryjnego. Zdolność sukralfatu do zapobiegania szpitalnemu zapaleniu płuc nie została jednak dobrze udowodniona i nie zaleca się jego rutynowego stosowania (14). Zamiast tego, wysiłki powinny być skierowane na ograniczenie stosowania profilaktyki wrzodów stresowych do populacji o wysokim ryzyku klinicznie istotnego krwawienia, czyli pacjentów z koagulopatią i przedłużającą się niewydolnością oddechową. Większość chorych, którzy nie przebywają na OIT, nie powinna otrzymywać profilaktyki przeciwodleżynowej. Ryzyko wystąpienia NP związane ze stosowaniem inhibitorów pompy protonowej nie zostało dobrze zbadane.
Wybiórcza dekontaminacja przewodu pokarmowego (SDD) polega na sterylizacji jamy ustno-gardłowej i przewodu pokarmowego u pacjentów wentylowanych mechanicznie w celu zapobiegania aspiracji dużej liczby potencjalnie patogennych drobnoustrojów i następowej VAP. Większość ocen SDD obejmowała doustne (a czasem żołądkowe) stosowanie miejscowej polimyksyny, aminoglikozydu i amfoterycyny. W wielu przypadkach dodawano krótkie kursy antybiotyków dożylnych. W co najmniej 10 metaanalizach wykazano zmniejszenie ryzyka VAP przy stosowaniu SDD. Dodanie dożylnych antybiotyków może również przynieść korzyść w zakresie śmiertelności. Jednak długoterminowe ryzyko pojawienia się organizmów opornych i niewystarczające dane dotyczące efektywności kosztowej SDD nie pozwalają na zalecenie jej rutynowego stosowania (14).
Istnieje kilka strategii zapobiegawczych ukierunkowanych na ograniczenie aspiracji zanieczyszczeń z obwodów respiratora, filtrów i przewodów. Zalecane strategie, wymienione w Tabeli III, strona 16, obejmują unikanie rutynowych zmian obwodów respiratora (wymieniaj przewody tylko wtedy, gdy są widocznie zanieczyszczone lub u nowego pacjenta), stosowanie wymienników ciepła i wilgoci zamiast podgrzewanych nawilżaczy oraz zmniejszenie częstości wymiany wymienników ciepła i wilgoci (1,11,14).
Plany wypisu/kontynuacji
Pacjentów należy obserwować w szpitalu do czasu uzyskania pewności, że odpowiadają na leczenie i następuje u nich poprawa stanu klinicznego. Ocena strategii szybkiego przejścia pacjentów na terapię doustną jest ograniczona. Jednakże, jeśli stan pacjenta poprawia się, toleruje on terapię doustną, ma sprawny przewód pokarmowy i wyizolowano u niego drobnoustrój wrażliwy na dostępne antybiotyki doustne, można przejść na terapię doustną. Jeśli nie wyizolowano żadnego drobnoustroju, ale u pacjenta zdecydowanie stwierdzono NP, wybrane antybiotyki doustne powinny mieć takie samo spektrum działania jak wcześniej podawane antybiotyki dożylne. W wielu przypadkach pacjenci będą mieli zakażenie drobnoustrojem, który jest wrażliwy tylko na antybiotyki podawane dożylnie. Pacjenci ci mogą być wystarczająco chorzy, aby ukończyć pełny tygodniowy kurs dożylny w szpitalu, ale jeśli nie mają aktywnych chorób współistniejących i ich stan się poprawił, mogą mieć założoną linię PICC (lub inny długoterminowy dostęp dożylny) i otrzymywać pozostałą część terapii w domu lub w innym miejscu o mniejszym natężeniu.
Wszystkich pacjentów, u których wystąpi NP, należy szukać odwracalnych przyczyn aspiracji, a w przypadku wyizolowania wielolekoopornych drobnoustrojów należy o tym poinformować każdą placówkę, do której pacjent jest przenoszony, lekarza podstawowej opieki zdrowotnej lub pielęgniarkę domową, którzy przejmą opiekę po wypisie.
- Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med. 2005;171:388-416.
- Warren DK, Shukla SJ, Olsen MA, et al. Outcome and attributable cost of ventilator-associated pneumonia among intensive care unit patients in a suburban medical center. Crit Care Med. 2003;31:1312-7.
- Flanders SA, Collard HR, Saint S. Preventing Nosocomial Pneumonia. In: Lautenbach E, Woeltje K, eds. The Society for Healthcare Epidemiology of America: Practical Handbook for Healthcare Epidemiologists. Thorofare, NJ: Slack, 2004:69-78.
- Pugin J, Auckenthaler R, Mili N, Janssens JP, Lew PD, Suter PM. Diagnosis of ventilator-associated pneumonia by bacteriologic analysis of bronchoscopic and nonbronchoscopic „blind” bronchoalveolar lavage fluid. Am Rev Respir Dis. 1991;143:1121-9.
- Singh N, Rogers P, Atwood CW, Wagener MM, Yu VL. Short-course empiric antibiotic therapy for patients with pulmonary infiltrates in the intensive care unit. A proposed solution for indiscriminate antibiotic prescription. Am J Respir Crit Care Med. 2000;162:505-11.
- Gibot S, Cravoisy A, Levy B, Bene MC, Faure G, Bollaert PE. Soluble triggering receptor expressed on myeloid cells and the diagnosis of pneumonia. N Engl J Med. 2004;350:451-8.
- Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care Med. 2002;165:867-903.
- Paul M, Benuri-Silbiger I, Soares-Weiser K, Leibovici L. Beta lactam monotherapy versus beta lactam-aminoglycoside combination therapy for sepsis in immunocompetent patients: systematic review and metaanalysis of randomised trials. BMJ. 2004;328:668.
- Chastre J, Wolff M, Fagon JY, et al. Comparison of 8 vs 15 days of antibiotic therapy for ventilator-associated pneumonia in adults: a randomized trial. JAMA. 2003;290:2588-98.
- Dennesen PJ, van der Ven AJ, Kessels AG, Ramsay G, Bonten MJ. Resolution of infectious parameters after antimicrobial therapy in patients with ventilator-associated pneumonia. Am J Respir Crit Care Med. 2001;163:1371-5.
- Collard HR, Saint S, Matthay MA. Prevention of ventilator-associated pneumonia: an evidence-based systematic review. Ann Intern Med. 2003;138:494-501.
- Drakulovic MB, Torres A, Bauer TT, Nicolas JM, Nogue S, Ferrer M. Supine body position as a risk factor for nosocomial pneumonia in mechanically ventilated patients: a randomised trial. Lancet. 1999;354:1851-8.
- Dezfulian C, Shojania K, Collard HR, Kim HM, Matthay MA, Saint S. Subglottic secretion drainage for preventing ventilator-associated pneumonia: a metaanalysis. Am J Med. 2005;118:11-8.
- Dodek P, Keenan S, Cook D, et al. Evidence-based clinical practice guideline for the prevention of ventilator-associated pneumonia. Ann Intern Med. 2004;141:305-13.
.