Wprowadzenie do wiązań chemicznych
Schematy Lewisa dla związków molekularnych/jonów
Aby narysować schematy Lewisa dla związków molekularnych lub jonów, wykonaj następujące kroki (będziemy używać H2O jako przykład do naśladowania):
1) Policz liczbę elektronów walencyjnych związku molekularnego lub jonu. Pamiętaj, jeśli są dwa lub więcej tego samego elementu, to musisz podwoić lub pomnożyć przez liczbę atomów liczbę elektronów walencyjnych. Postępuj zgodnie z numerem grupy cyfr rzymskich, aby zobaczyć odpowiednią liczbę elektronów walencyjnych dla tego pierwiastka.
Elektrony walencyjne:
Tlen (O)-Grupa VIA: zatem, jest 6 elektronów walencyjnych
Wodór (H)-Grupa IA: zatem, jest 1 elektron walencyjny
UWAGA: Istnieją DWA atomy wodoru, więc pomnóż 1 elektron walencyjny X 2 atomy
Ogółem: 6 + 2 = 8 elektronów walencyjnych
2) Jeżeli dana cząsteczka jest jonem, pamiętaj, aby dodać lub odjąć odpowiednią liczbę elektronów do sumy z kroku 1.
Dla jonów, jeżeli jon ma ładunek ujemny (anion), dodaj odpowiednią liczbę elektronów do całkowitej liczby elektronów (np. jeżeli NO3- ma ładunek ujemny 1-, to dodajemy 1 dodatkowy elektron do całkowitej liczby elektronów; 5 + 3(6)= 23 +1 = 24 elektrony). Znak – oznacza, że cząsteczka ma ogólny ładunek ujemny, więc musi mieć ten dodatkowy elektron. Dzieje się tak dlatego, że aniony mają wyższe powinowactwo elektronowe (tendencję do zdobywania elektronów). Większość anionów składa się z niemetali, które mają wysoką elektroujemność.
Jeśli jon ma ładunek dodatni (kation), odejmij odpowiednią liczbę elektronów do całkowitej liczby elektronów (np. H3O+ ma ładunek dodatni 1+, więc odejmujesz 1 dodatkowy elektron do całkowitej liczby; 6 + 1(3) = 9 – 1 = 8 całkowitych elektronów). Znak + oznacza, że cząsteczka ma ogólny ładunek dodatni, więc musi jej brakować jednego elektronu. Kationy są dodatnie i mają słabsze powinowactwo do elektronów. Składają się one głównie z metali; ich promienie atomowe są większe niż niemetali. To w konsekwencji oznacza, że ekranowanie jest zwiększone, a elektrony mają mniejszą tendencję do przyciągania do „ekranowanego” jądra.
W naszym przykładzie woda jest cząsteczką neutralną, dlatego nie trzeba dodawać ani odejmować elektronów.
3) Napisz symbole pierwiastków, upewniając się, że wszystkie atomy są uwzględnione (np. H2O, napisz O i 2 H po obu stronach tlenu). Zacznij od dodania pojedynczych wiązań (1 para elektronów) do wszystkich możliwych atomów, upewniając się, że są one zgodne z regułą oktetu (z wyjątkiem reguły duetu i innych pierwiastków wymienionych powyżej).
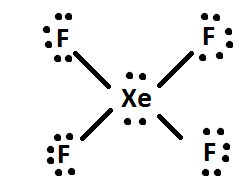
4) Jeśli są jakieś resztki elektronów, dodaj je do centralnego atomu cząsteczki (np. XeF4 ma 4 dodatkowe elektrony po rozłożeniu, więc 4 dodatkowe elektrony są podane do Xe: tak. Na koniec, jeśli to możliwe, zmień układ par elektronowych w wiązania podwójne lub potrójne.