Biologia prática
Classe prática ou demonstração
Peróxido de hidrogénio (H2O2) é um subproduto da respiração e é feito em todas as células vivas. O peróxido de hidrogénio é nocivo e deve ser removido assim que é produzido na célula. As células fazem a enzima catalase para remover o peróxido de hidrogénio.
Esta investigação analisa a taxa de produção de oxigénio pela catalase em puré de batata, uma vez que a concentração de peróxido de hidrogénio varia. O oxigénio produzido em 30 segundos é recolhido sobre a água. Depois é calculada a taxa de reacção.
Organização da aula
Esta investigação pode ser realizada como uma demonstração em duas concentrações diferentes, ou com grupos de estudantes trabalhando cada um com uma concentração diferente de peróxido de hidrogénio. Os estudantes individuais poderão então ter tempo para recolher dados repetidos. Grupos de três poderiam trabalhar para recolher resultados para 5 concentrações diferentes e rodar os papéis de manipulador de aparelhos, leitor de resultados e escriba. A recolha e comparação dos resultados das aulas permite aos alunos procurar dados anómalos e inconsistentes.
Aparelhos e Produtos Químicos
Para cada grupo de alunos:
Recipiente pneumático/ tigela de plástico/ acesso à pia de água adequada
Frasco cónico, 100 cm3, 2
Seringa (2 cm3) para encaixar no segundo orifício do bujão de borracha, 1
Cilindro de medição, 100 cm3, 1
cilindro de medição, 50 cm3, 1
suporte de pinça, chefe e pinça, 2
cronómetro/ cronómetro
Para a aula – montada por técnico/ professor:
Peróxido de hidrogénio, gama de concentrações, 10 vol, 15 vol, 20 vol, 25 vol, e 30 vol, 2 cm3 por grupo de cada concentração (Nota 1)
Batata pura, fresca, em copo com seringa para medir pelo menos 20 cm3, 20 cm3 por grupo por concentração de peróxido investigada (Nota 2)
Batoque de borracha, 2-holed, para encaixar frascos cónicos de 100 cm3 – tubo de entrega num furo (ligado a tubos de borracha de 50 cm)
Saúde & Notas técnicas e de segurança
Usar protecção ocular e cobrir o vestuário quando manusear peróxido de hidrogénio.
Salpicos de puré de batata ou peróxido fora da pele imediatamente.
Cuidado da acumulação de pressão se os vasos de reacção ficarem bloqueados.
Cuidado de inserir a rolha no frasco cónico – tem de ser um ajuste apertado, por isso empurre e torça a rolha com cuidado.
1 Peróxido de hidrogénio: (Ver CLEAPSS Hazcard) As soluções com menos de 18 vol são de BAIXO PERIGO. Soluções com concentrações de 18-28 vol são IRRITANTES. Tenha cuidado ao remover a tampa do frasco de reagente, uma vez que a pressão do gás pode ter-se acumulado no interior. Diluir imediatamente antes de usar e colocar num frasco castanho limpo, porque a diluição também dilui o inibidor de decomposição. Manter em frascos castanhos, porque o peróxido de hidrogénio degrada-se mais rapidamente à luz. Deitar fora toda a solução não utilizada. Não devolver a solução às garrafas de reserva, porque os contaminantes podem causar decomposição e a garrafa de reserva pode explodir após algum tempo.
2 Batata pura pode irritar a pele de algumas pessoas. Faça fresco para cada lição, porque a actividade catalítica reduz notavelmente ao longo de 2/3 horas. Pode ser necessário adicionar água para a tornar menos viscosa e mais fácil de usar. Os discos de batata reagem muito lentamente.
3 Se as bolhas do tubo de borracha forem demasiado grandes, inserir uma pipeta de vidro ou tubo de vidro na extremidade do tubo de borracha.
Procedimento
SEGURANÇA: Usar protecção ocular e proteger o vestuário do peróxido de hidrogénio. Enxaguar salpicos de peróxido e puré de batata da pele o mais rapidamente possível.
Preparação
a Fazer apenas peróxido de hidrogénio diluído o suficiente, imediatamente antes da aula. Preparar em garrafas castanhas (Nota 1).
b Fazer puré de batata fresco para cada lição (Nota 2).
c Maquilhar batoques com 2 batoques, conforme descrito na lista de aparelhos e no diagrama.
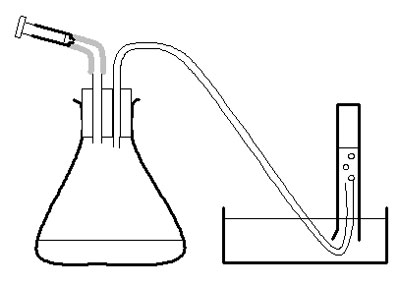
Investigação
d Utilizar a seringa grande para medir 20 cm3 de puré de batata no frasco cónico.
e Colocar a rolha firmemente no frasco – torcer e empurrar cuidadosamente.
f Encher a metade do recipiente, tigela ou pia com água.
g Encher o cilindro de medição de 50 cm3 com água. Inverter sobre o recipiente de água, com a extremidade aberta sob a superfície da água na tigela, e com a extremidade do tubo de borracha no cilindro de medição. Grampo no lugar.
h Medir 2 cm3 de peróxido de hidrogénio na seringa de 2 cm3. Colocar a seringa no lugar na rolha do frasco, mas não empurrar o êmbolo de imediato.
i Verificar se o tubo de borracha está seguro no cilindro de medição. Empurrar o êmbolo na seringa e iniciar imediatamente o cronómetro.
j Após 30 segundos, anotar o volume de oxigénio na garrafa de medição numa tabela de resultados adequada. (Nota 3.)
k Esvaziar e enxaguar o frasco cónico. Medir mais 20 cm3 de puré de batata dentro dele. Remontar o aparelho, encher novamente a garrafa de medição, e repetir de g a j com outra concentração de peróxido de hidrogénio. Utilizar uma garrafa de medição de 100 cm3 para concentrações de peróxido de hidrogénio acima de 20 vol.
l Calcular a taxa de produção de oxigénio em cm3/s.
m Traçar um gráfico da taxa de produção de oxigénio contra a concentração de peróxido de hidrogénio.
Notas didácticas
Observar as unidades de medição da concentração de peróxido de hidrogénio – estas não são unidades SI. 10 vol de peróxido de hidrogénio produzirá 10 cm3 de oxigénio a partir de cada cm3 que se decompõe.(Nota 1.)
Neste procedimento, 2 cm3 de peróxido de hidrogénio 10 vol libertarão 20 cm3 de oxigénio se a reacção for completada. 2 cm3 de líquido são adicionados ao frasco de cada vez. Assim, se o aparelho estiver livre de fugas, 22 cm3 de água devem ser deslocados na garrafa de medição com peróxido de hidrogénio de 10 vol. O oxigénio é solúvel em água, mas dissolve-se apenas lentamente em água à temperatura ambiente normal.
Utilizar esta informação como verificação da configuração prática. Valores inferiores a 22 cm3 mostram que o oxigénio escapou, ou o peróxido de hidrogénio não reagiu completamente, ou a concentração de peróxido de hidrogénio não é a esperada. Peça aos alunos para explicar como é que valores superiores a 22 cm3 podem acontecer.
Um erro de ± 0,05 cm3 na medição de peróxido de hidrogénio de 30 vol. pode cometer um erro de ± 1,5 cm3 na produção de oxigénio.
O fígado também contém catalase, mas o manuseamento de miudezas é mais controverso com os alunos e introduz um maior risco de higiene. Além disso, a reacção é tão vigorosa que as bolhas de mistura podem transportar pedaços de fígado para o tubo de distribuição.
Se a recolha do gás sobre a água for complicada, e se tiver acesso a uma seringa de gás de 100 cm3, poderá, em vez disso, recolher o gás nesse tubo. Não se esqueça de prender a seringa de gás com segurança mas com cuidado.
A reacção é exotérmica. Os alunos podem notar o calor se colocarem as mãos no frasco cónico. Como é que isto irá afectar os resultados?
Saúde e segurança verificada, Setembro de 2008
Downloads
Descarregar a folha do aluno ![]() Investigar uma reacção controlada por enzimas: concentração de catalase e peróxido de hidrogénio (67 KB) com perguntas e respostas
Investigar uma reacção controlada por enzimas: concentração de catalase e peróxido de hidrogénio (67 KB) com perguntas e respostas