Cell Biology 07: Microtubules and Cell Division
Estas são notas da palestra 7 do curso de Biologia Celular da Harvard Extension.
Palestra 6 introduziu microtubules, e esta palestra irá discutir o seu papel na divisão celular. Aqui está um vídeo introdutório:
Visão geral do ciclo celular
O ciclo celular – o processo de divisão e replicação celular – é governado por uma série de interruptores bioquímicos chamados sistema de controlo do ciclo celular.
O ciclo celular é dividido em fases que são divididas em fases – as pessoas irão referir-se às “4 fases” mas depois há de facto 5, e as pessoas também usam outras palavras para agrupar essas fases, e outras palavras para as subdividir. Fiz o meu melhor para resumir a relação entre estes termos na tabela seguinte. (modificado/expandido da Wikipedia):
| o suposto “4 fases” | subfases | |
|---|---|---|
| non-dividing | Gap 0 (G0) | |
| interphase | Gap 1 (G1) | G1a R G1b |
| Síntese (S) | ||
| Gap 2 (G2) | /td> | |
| Mitose | Mitose (M) |
O conteúdo de cada fase é lindamente resumido nesta notável imagem Wikimedia Commons de Kelvinsong:

As células humanas mais rápidas a dividir podem completar um ciclo celular em cerca de 24 horas (G1: 9h, S: 10h, G2: 4h, M: 30 min). A levedura pode terminar um ciclo em 30 minutos, e as células Drosophila de divisão mais rápida demoram tão pouco como 8 minutos.
Os controladores principais deste processo incluem as ciclinas, que regulam a quinase dependente da ciclina ou CDK. Recordar que as kinases são proteínas que fosforilam outras proteínas. A fosforilação CDK dos seus alvos permite que a mitose prossiga. Para ser preciso, o factor de promoção da maturação ou MPF é um complexo heterodimérico obrigatório composto de ciclina B e CDK, que só faz a sua acção fosforilizante quando ambas as proteínas estão presentes.
Rol de microtubos
Microtubos são críticos durante todo o ciclo celular – organizam os componentes celulares e dividem-nos em dois. Eis uma série de vídeos do ciclo celular que destacam o papel das microtubulas:
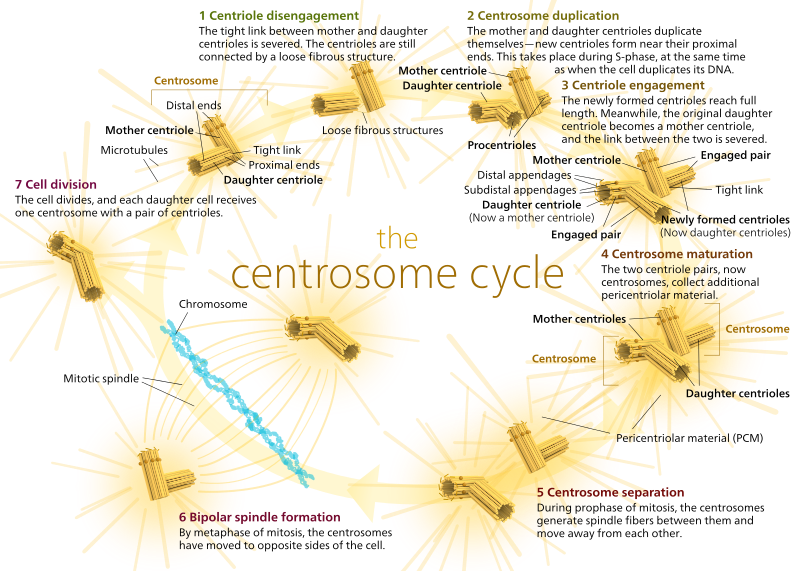
Em animais, as células quiescentes e mesmo as células em interfase têm geralmente apenas um MTOC, chamado centrossoma, que serve como centro central para todas as microtubulas na célula. Um centrooma é composto por dois centrioles, como se mostra abaixo (graças novamente a Kelvinsong):

Os dois centrioles desengatam-se um do outro e replicam-se durante a fase S, e depois separam-se para formar ‘pólos’ opostos da célula durante a fase M, de modo que agora existem dois MTOCs, cada um dos quais será eventualmente o único MTOC de uma nova célula (outra imagem do chefe Kelvinsong):
Durante a mitose, então, tem os dois ‘pólos’ da célula, cada um com microtubos ancorados na extremidade (-) e com as suas extremidades (+) sobrepostas, apontando para o centro da célula, como mostrado aqui (imagem Wikimedia Commons de Lordjuppiter):
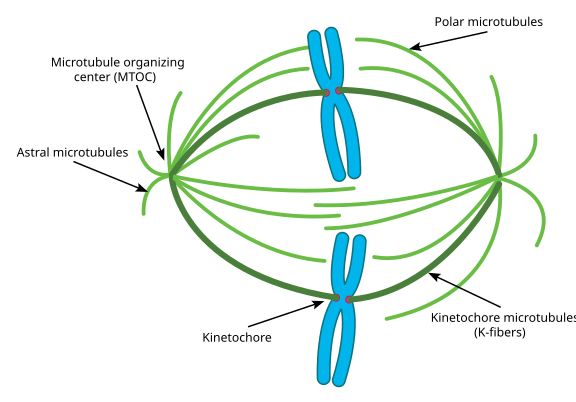
que tudo isto se chama aparelho de fuso, e a área onde os dois microtubos MTOCs se sobrepõem é chamada a ‘zona de interdigitação’. Ouve-se por vezes cada MTOC e o seu conjunto de microtubos tipo ouriço chamado ‘asterisco mitótico’.’
Diz-se que os microtubos durante esta fase se enquadram em três categorias:
- Microtubos astrais apontam para fora, em direcção ao córtex celular, a fim de ancorar todo o aparelho do fuso ao longo do eixo de divisão celular.
- Microtubos de cinetócitos ligados ao cinetócito dos cromatídeos.
- Microtubos polares, orientados paralelamente uns aos outros mas em direcções opostas, são cruciais para afastar o aparelho do fuso durante a mitose. (De facto, os microtubos polares também estão presentes mais cedo e ajudam a afastar os centrosomas durante a prófase).
Se preferir fotografias em vez de diagramas, eis como é todo o aparelho do fuso, com cromatídeos em azul, microtubos em verde, e os cinetos como pontos vermelhos:

Microtubos tornam-se muito mais dinâmicos durante a mitose: mais gama-tubulin promove uma nucleação mais fácil, mas o XMAP215, um estabilizador de microtubos, é fosforilado e assim inactivado durante a mitose, deixando o Kinesin-13 livre para catastrofizar os microtubos. Fortunas são feitas e perdidas rapidamente. A meia-vida de um microtubo durante a mitose é de cerca de 15 minutos, em comparação com 30 minutos durante a interfase. As pessoas estudam a dinâmica dos microtubos usando FRAP: adicionar um microtubo fluorescente, branqueá-lo e ver a rapidez da remontagem com base na rapidez com que a fluorescência reaparece. +Dicas também desempenham um papel importante na ajuda e montagem dos microtubos.
Kinesin-5 tem duas cabeças polares que se ligam a microtubos opostos e tentam caminhar em direcção à (+) extremidade de cada um. Isto afasta os dois microtubos e fornece a força motriz para a separação dos MTOCs.
O ADN centromérico tem baixa entropia de informação e histórias especiais que diferem das outras cromatinas. Os centrómeros são uma parte do genoma que quase nunca se apanha na sequência de gerações seguintes, mesmo a uma profundidade realmente elevada. Isto porque os centrómeros estão a servir um propósito diferente do resto do genoma: a sequência ali é favorável à interacção com proteínas centrómeros e fixação de cinéto-core. As coesinas são proteínas que mantêm os dois cromatídeos irmãos juntos. Referimo-nos às proteínas de cinéto-core como tendo duas camadas, o cinéto-core interno e o cinéto-core externo.
Durante a prometafase, os cromossomas movem-se para trás e para a frente. As cinesinas ancoram os cromossomas aos microtubos do cinétocoleo para além da ponta onde a Kinesina-13 está a despolimerizar os microtubos, ajudada por uma escassez de dímeros tubulínicos disponíveis. Uma combinação de proteínas motoras, proteínas que interagem com os microtubulos e esteira serve para mover os cromossomas. Entretanto, a dynein e a dynactin – proteínas motoras que caminham em direcção à (-) extremidade – trabalham nos microtubos astrais, puxando os MTOCs em direcção à periferia celular. Em metafase, os cromatídeos passam a ser alinhados ao longo da ‘placa de metafase’.
Durante este processo, o envelope nuclear dissolve-se e a importação nuclear torna-se irrelevante. Ran-GEF localiza-se perto dos cromossomas e gera altas concentrações de Ran-GTP que fornece energia para alguns processos necessários (?).
As células têm algum mecanismo para detectar a tensão nos microtubos que indica os seus cromatídeos de fixação antes que a mitose possa prosseguir. Certificar-se de que cada cromatídeo está devidamente ancorado é crucial para evitar a aneuploidia.
Por falar nisso, outros elementos citoesqueléticos para além dos microtubos desempenham também um papel fundamental no ciclo celular. Na citocinese, a actina forma um anel contrátil e, com a ajuda das proteínas motoras da miosina II, cinge a célula em dois.
Importância de organismos modelo
A descoberta de processos reguladores do ciclo celular baseou-se fortemente em algumas características limpas de organismos modelo populares.
Saccharomyces cerevisiae (levedura de brotação) e Schizosaccharomyces pombe (levedura de fissão) podem existir como haploids ou diploids. Isto é importante porque, na fase haplóide, uma mutação pode derrubar um gene – não é necessário atingir os dois alelos. E na levedura, muitas mutações, especialmente nos genes Cdc__ (controlo de divisão celular), são dependentes da temperatura, onde uma proteína com uma mutação falsa ainda pode funcionar correctamente a temperaturas ‘permissivas’ mas perde a sua função nativa a temperaturas ‘não-permissivas’. Isto torna possível o estudo do fenótipo knockout (à temperatura “não permissiva”), tendo ainda a conveniência de poder propagar facilmente os organismos (à temperatura “permissiva”). Todo o genoma de S. cerevisiae está disponível como bibliotecas de plasmídeos, tornando possível o rastreio para o qual o plasmídeo resgata o fenótipo de um determinado mutante. É assim que muitos dos genes que regulam o ciclo celular foram descobertos.
Em S. cerivisiae, a germinação faz parte da fase G1, e assim que a célula filha atinge um determinado tamanho, num momento chamado “START”, os dois comprometem-se a entrar em S e, por fim, a completar o ciclo celular. As células mamíferas têm o seu próprio ponto de compromisso chamado ponto de restrição ou R, em G1, que é análogo a START.
Cdc28 mutantes sensíveis à temperatura nãopermissiva. O gene Cdc28 codifica o homólogo da levedura da nossa quinase dependente da ciclina (CDK) que, quando e só quando complexada com ciclina, pode fosforilatar outras proteínas para regular a sua participação nas fases do ciclo celular. Os mutantes sensíveis à temperatura à temperatura nãopermissiva ficam presos, incapazes de se desenvolverem e entrarem na fase S. Em vez disso, comportam-se como células do tipo selvagem privadas de nutrientes: crescem suficientemente grandes para passar START mas depois não continuam.
Xenopus (uma espécie de sapo) revelou-se crítico para a compreensão do ciclo celular, porque a sua reprodução envolve um número muito grande de células (ou seja, material de partida suficiente para as flores ocidentais, etc.) que estão perfeitamente sincronizadas (ou seja, todas estão na mesma fase do ciclo celular no mesmo momento. (Compare com levedura, por exemplo, onde as células não estarão todas na mesma fase ao mesmo tempo). Também o próprio óvulo é grande e fácil de trabalhar, e os ciclos celulares múltiplos seguem a fertilização. Em rãs, os ovos começam a divisão meiótica, mas depois são parados na fase G2 durante 8 meses enquanto crescem em tamanho e armazenam coisas que serão necessárias para o crescimento após a fertilização.
filamentos intermediários
Além de microfilamentos e microtubos, as células eucarióticas também têm um conjunto de ‘outras’ proteínas citoesqueléticas chamadas filamentos intermediários (IFs). Embora mais diversos do que os microfilamentos e microtubos, os FI não são apenas um termo de “qualquer outro filamento” – são, antes, um grupo de proteínas relacionadas. Geralmente estendem-se através do citoplasma e do envelope nuclear interno, são não-polares e não têm proteínas motoras associadas a eles. Têm uma grande resistência à tracção e são muito estáveis, com uma taxa de câmbio lenta e pouca decomposição, embora a fosforilação possa promover a sua desmontagem. Aqui estão alguns exemplos populares:
- As queratinas encontram-se em células epiteliais, células mesoderma e neurónios. Elas fornecem força e apresentam-se em formas ácidas e básicas. Cada uma pode formar o seu próprio filamento, mas a maioria dos FI consistem em dois filamentos – um básico e um ácido, uma espécie de torcidos à volta um do outro. O cabelo e as unhas são feitos de queratina ‘dura’ rica em cisteína para ligações dissulfeto, o que proporciona a imensa força. Os permanentes e o alisamento dependem da redução das ligações de dissulfeto, remodelando o cabelo e depois reformando as ligações de dissulfeto. Também tem queratina ‘suave’ na sua pele.
- Desminas como a vimentina são encontradas em células mesenquimais (osso, cartilagem e gordura).
- Neurofilamentos estão em axónios neuronais e regulam o seu diâmetro, que por sua vez determina a velocidade de propagação potencial de acção.
- As laminas são as mais difundidas e acredita-se que sejam mais semelhantes ao ancestral filogenético de todos os outros FI. Fornecem apoio estrutural para a membrana nuclear. Podem ajudar a espaçar os complexos de poros nucleares e também organizar o ADN.
Finalmente, um vídeo resumo: