Creative Proteomics Blog
Western blot foi introduzido por Towbin et al. em 1979, que é um método comummente utilizado para a análise de proteínas. Pode ser usado para análise qualitativa e semi-quantitativa de proteínas. Para a realização do western blot, existem três elementos, separação de proteínas por tamanho, transferência de proteínas para um suporte sólido, e marcação de proteínas por anticorpos primários e secundários para visualização.
O Princípio do Western Blot
Western blot é realizado utilizando electroforese em gel de polipropileno. SDS-PAGE permite que amostras de proteínas sejam separadas e transferidas para um suporte sólido, como a membrana de nitrocelulose (NC) ou difluoreto de polivinilideno (PVDF). O suporte sólido pode absorver a proteína e manter a sua actividade biológica inalterada. A membrana de suporte sólido transferida é chamada de blot e é tratada com uma solução proteica para bloquear o local de ligação hidrofóbica na membrana. A membrana é tratada com o anticorpo (anticorpo primário) das proteínas alvo. Apenas as proteínas a estudar podem ligar-se especificamente ao anticorpo primário para formar um complexo antigénio-anticorpo. Depois de o anticorpo primário ser lavado e removido, apenas a posição da proteína alvo se liga ao anticorpo primário. As membranas tratadas com o anticorpo primário são tratadas com um anticorpo secundário rotulado após lavagem. Após o tratamento, o anticorpo secundário rotulado que se liga ao anticorpo primário forma um complexo de anticorpos que pode indicar a localização do anticorpo primário, tanto a localização da proteína em estudo.
p>O procedimento do Western Blot
Existem seis passos envolvidos no western blot, incluindo a preparação da amostra, electroforese em gel, transferência de proteínas, bloqueio, incubação de anticorpos, e detecção e visualização de proteínas.
1. Preparação da amostra.
Proteínas podem ser extraídas de diferentes amostras, tais como tecidos ou células. Uma vez que as amostras de tecidos apresentam um maior grau de estrutura, os tecidos são primeiro decompostos pela invenção mecânica, tal como o homogeneizador ou a sonicação. Os inibidores de protease e fosfatase são normalmente utilizados para evitar a digestão da amostra a temperaturas frias. Após a extracção de proteínas, é importante detectar a concentração de proteínas, o que permite a massa de proteínas carregada em cada poço. E um espectrofotómetro é frequentemente utilizado para concentração de proteínas.
2. Electroforese de gel.
 br> O gel mais comummente utilizado é gel de poliacrilamida (PAG) e tampões carregados com sulfato de sódio dodecilo (SDS). O Western blot usa dois tipos de gel de agarose: gel empilhador que é usado para concentrar todas as proteínas numa só banda e gel separador que permite separar as proteínas de acordo com o seu peso molecular. As proteínas mais pequenas migram mais rapidamente em SDS-PAGE quando é aplicada uma tensão. PAGE pode separar proteínas de 5 a 2.000 kDa de acordo com o tamanho uniforme dos poros, que é controlado pela Concentração diferente de PAG. Tipicamente os géis separadores são feitos em 5%, 8%, 10%, 12% ou 15%. Quando escolhemos a percentagem apropriada do gel separador, devemos considerar o tamanho das proteínas alvo. Quanto menor for o peso conhecido das proteínas, maior percentagem de géis deve ser utilizada.
br> O gel mais comummente utilizado é gel de poliacrilamida (PAG) e tampões carregados com sulfato de sódio dodecilo (SDS). O Western blot usa dois tipos de gel de agarose: gel empilhador que é usado para concentrar todas as proteínas numa só banda e gel separador que permite separar as proteínas de acordo com o seu peso molecular. As proteínas mais pequenas migram mais rapidamente em SDS-PAGE quando é aplicada uma tensão. PAGE pode separar proteínas de 5 a 2.000 kDa de acordo com o tamanho uniforme dos poros, que é controlado pela Concentração diferente de PAG. Tipicamente os géis separadores são feitos em 5%, 8%, 10%, 12% ou 15%. Quando escolhemos a percentagem apropriada do gel separador, devemos considerar o tamanho das proteínas alvo. Quanto menor for o peso conhecido das proteínas, maior percentagem de géis deve ser utilizada.
3. Transferência de proteínas.
Após a separação das proteínas por electroforese do gel, as proteínas são movidas do interior do gel para uma membrana de suporte sólida para tornar as proteínas acessíveis à detecção de anticorpos. O principal método de transferência de proteínas chama-se electroblotting, que utiliza um campo eléctrico orientado perpendicularmente à superfície do gel, para puxar as proteínas para fora do gel e mover-se para a membrana. Pode ser feito em condições semi-secas ou húmidas, enquanto que as condições húmidas são normalmente mais fiáveis, uma vez que é menos provável que seque o gel. Como mostra a figura da esquerda, a membrana é colocada entre a superfície do gel e o filtro. O sanduíche de transferência é criado da seguinte forma: um bloco de fibras (esponja), papéis filtrantes, o gel, uma membrana, papéis filtrantes, um bloco de fibras (esponja).
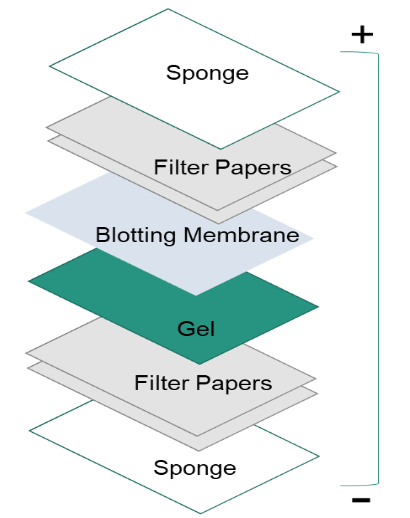 4. Bloqueio.
4. Bloqueio.
Bloqueio é um passo importante na mancha ocidental para evitar a ligação de anticorpos à membrana de forma não específica. Os bloqueadores típicos mais frequentemente utilizados são o BSA e o leite seco não gordo. Quando a membrana é colocada na solução diluída de proteínas, as proteínas ligam-se a todos os locais da membrana onde as proteínas alvo não se ligaram. Desta forma, o “ruído” no produto final da mancha ocidental pode ser reduzido e resultar em resultados mais claros.
5. Incubação de anticorpos.
br> Após bloqueio, o anticorpo primário liga-se à proteína alvo quando o anticorpo primário é incubado com a membrana. A escolha de um anticorpo primário depende do antigénio a ser detectado. A lavagem da membrana com a solução tampão anti-corpo é útil para minimizar o fundo e remover anticorpos não ligados. Depois de lavar a membrana, a membrana é exposta ao anticorpo secundário conjugado com a enzima específica. Ao realizar a incubação de anticorpos secundários, o anticorpo secundário rotulado pode ligar-se ao anticorpo primário que tenha reagido com as proteínas alvo. Com base nas espécies do anticorpo primário, podemos escolher o anticorpo secundário apropriado.
6. Detecção e visualização de proteínas.
Um substrato reage com a enzima que está ligada ao anticorpo secundário para gerar substância colorida. Permite-nos conhecer a densitometria e a localização da proteína alvo. E as aproximações de tamanho são feitas comparando as bandas de proteínas com o marcador. Há vários sistemas de detecção disponíveis para visualização de proteínas, tais como detecção colorimétrica, detecção quimioluminescente, detecção radioactiva, e detecção fluorescente. O sistema de electrochemiluminescência (ECL) é o método de detecção mais comum.
A mancha ocidental é normalmente utilizada para a detecção qualitativa de proteínas e modificações pós-tradução (por exemplo, fosforilação). Além disso, também pode ser usado em diagnósticos médicos, como o teste de VIH ou o teste de BSE.