Factos do Elemento Nitrogénio
O elemento químico nitrogénio é classificado como um gás e um não-metal. Foi descoberto em 1772 por Daniel Rutherford e independentemente por Carl Scheele.

Data Zone
| Classificação: | Azoto é um gás e um não-metal |
| Cor: | incolor |
| Peso atómico: | 14.0067 |
| gás | |
| -210.1 oC, 63.05 K | |
| Ponto de fusão: | -195.8 oC, 77.4 K |
| Electrões: | |
| Neutrons no isótopo mais abundante: | 7 |
| Electron shells: | 2,5 |
| 1s2 2s2 2p3 | |
| Densidade @ 20oC: | 0.0012506 g/cm3 |
Mostrar mais, incluindo: Aquecimento, Energias, Oxidação,
Reacções, Compostos, Raios, Condutividades
| 17.3 cm3/mol | |
| Estrutura: | hcp: hexagonal close-packed |
| Capacidade térmica específica | 1.04 J g-1 K-1 |
| Calor de fusão | 0.720 kJ mol-1 de N2 |
| 473 kJ mol-1 | |
| Calor de vaporização | 5.57 kJ mol-1 de N2 |
| 1ª energia de ionização | 1402.3 kJ mol-1 |
| 2ª energia de ionização | 2856 kJ mol-1 |
| 3ª energia de ionização | 4578 kJ mol-1 |
| afinidade electrónica | -6.75 kJ mol-1 |
| Número mínimo de oxidação | -3 |
| Número mínimo de oxidação comum. | -3 |
| Número máximo de oxidação | 5 |
| Nº máximo de oxidação comum. | 5 |
| Electronegatividade (Escala de Paulagem) | 3.04 |
| Volume de polarizabilidade | 1.1 Å3 |
| Reacção com ar | nenhum |
| nenhum | |
| Reacção com 6 M HCl | nenhum |
| Reacção com 6 M NaOH | nenhum |
| Óxido(s) | N2O, NO, NO2, N2O5 |
| Hidreto(s) | NH3 (amoníaco), N2H4 (hidrazina), HN3 (ácido hidrazóico) |
| Cloreto(s) | NCl3 |
| 65 pm | |
| Raio iónico (1+ ião) | – |
| Raio iónico (2+ iões) | |
| Raio iónico (3+ iões) | 30 pm |
| Raio iónico (1- ião) | – |
| Raio iónico (2-ião) | |
| Raio iónico (3-ião) | |
| 0.02583 W m-1 K-1 | |
| Condutividade eléctrica | – |
| Ponto de congelação/ponto de fusão: | -210.1 oC, 63.05 K |
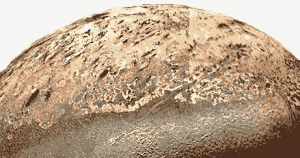 p>Nasa Image. Os géisers de nitrogénio de Triton empurram partículas negras quilómetros acima da superfície. Estes são soprados pelos ventos em Tritão e formam depósitos negros na superfície do satélite. (Ver Facts, below.)
p>Nasa Image. Os géisers de nitrogénio de Triton empurram partículas negras quilómetros acima da superfície. Estes são soprados pelos ventos em Tritão e formam depósitos negros na superfície do satélite. (Ver Facts, below.) 
Azoto Líquido condensa o vapor de água do ar circundante. NASA.
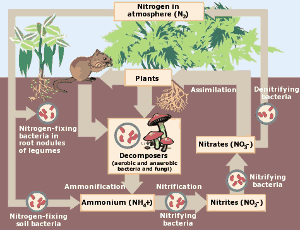 p>O ciclo do azoto. Clique aqui para ampliar a imagem. (Cortesia da Agência de Protecção Ambiental)
p>O ciclo do azoto. Clique aqui para ampliar a imagem. (Cortesia da Agência de Protecção Ambiental) Descoberta de Nitrogénio
Em 1674 o médico inglês John Mayow demonstrou que o ar não é um elemento único, é composto por diferentes substâncias. Ele fez isto ao mostrar que apenas uma parte do ar é combustível. A maior parte não é. (1)
Quase um século mais tarde, o químico escocês Joseph Black realizou um trabalho mais detalhado sobre o ar. Depois de remover o oxigénio e o dióxido de carbono, parte do ar permaneceu.
Black usou fósforo queimado como passo final na remoção do oxigénio. (O fósforo queimado tem uma afinidade muito elevada com o oxigénio e é eficiente na sua remoção completa). O negro atribuiu então um estudo mais aprofundado dos gases no ar ao seu aluno de doutoramento, Daniel Rutherford. (2)
Rutherford construiu sobre o trabalho de Black e numa série de passos removeu completamente o oxigénio e o dióxido de carbono do ar. Ele mostrou que, tal como o dióxido de carbono, o gás residual não podia suportar a combustão ou organismos vivos. Ao contrário do dióxido de carbono, porém, o nitrogénio era insolúvel na água e em soluções alcalinas. Rutherford relatou a sua descoberta em 1772 de “ar nocivo”, a que agora chamamos nitrogénio. (3)
O farmacêutico sueco Carl Scheele descobriu o azoto independentemente, chamando-lhe ar gasto.
Scheele absorveu oxigénio de várias maneiras, incluindo a utilização de uma mistura de enxofre e limalhas de ferro e fósforo queimado. Depois de remover o oxigénio, ele relatou um gás residual que não suportaria a combustão e tinha entre dois terços e três quartos do volume do ar original. Scheele publicou os seus resultados em 1777, embora se pense que o trabalho tenha sido levado a cabo em 1772. (4)
Embora Rutherford e Scheele sejam agora creditados conjuntamente com a descoberta de azoto, parece ter sido descoberto mais cedo por Henry Cavendish, mas não publicado.
Antes de 1772 (a data precisa é desconhecida – Priestley refere-se a ela no seu trabalho “Experiments and Observations Made in and Before the Year 1772”) Cavendish escreveu a Joseph Priestley descrevendo “ar queimado”.
O ‘ar queimado’ tinha sido preparado passando ar repetidamente sobre carvão vermelho quente (removendo o oxigénio) e depois borbulhando o gás restante através de uma solução de potassa cáustica (hidróxido de potássio) que teria removido o dióxido de carbono.
Cavendish escreveu: “Verificou-se que a gravidade específica deste ar diferia muito pouco da do ar comum; dos dois, parecia bastante mais leve. Extinguiu a chama, e tornou o ar comum impróprio para tornar os corpos queimados da mesma forma que o ar fixo, mas em menor grau, como uma vela que queimava cerca de 80″ em puro ar comum, e que se apagava imediatamente em ar comum misturado com 6/55 de ar fixo, queimado cerca de 26″ em ar comum misturado com a mesma porção deste ar queimado”. (5)
Em 1790 o químico francês Jean-Antoine-Claude Chaptal deu ao elemento ‘nitrogénio’ o nome de ‘nitrogénio’, depois de experiências que mostraram ser um constituinte de nitrogéneo, como se chamava então nitrato de potássio.
Factos interessantes sobre o nitrogénio
- Sobre 2,5% do peso dos organismos vivos provém do nitrogénio em moléculas orgânicas.
- Muitas das moléculas da vida contêm nitrogénio. É o quarto elemento mais abundante no corpo humano.
- Nitrogénio é o sétimo elemento mais abundante no universo.
- Em 1919, o mundo aprendeu pela primeira vez que os núcleos atómicos podiam ser desintegrados. Ernest Rutherford relatou que tinha bombardeado gás nitrogénio com partículas alfa (núcleos de hélio) e descobriu que era produzido hidrogénio. (Mais pesquisas de Patrick Blackett mostraram que as partículas alfa tinham transmutado azoto-14 para oxigénio-17 mais hidrogénio.)
li>O nitrogénio composto nitroglicerina pode ser utilizado para aliviar a angina, uma condição cardíaca que ameaça a vida.li>Satélite de Netuno Tritão tem cinco milhas de altura, géiseres movidos a nitrogénio.
Como a Terra, a atmosfera de Tritão é principalmente nitrogénio, mas Tritão é tão fria que o nitrogénio assenta na superfície como um sólido duro de rocha. O nitrogénio sólido permite que a luz fraca que chega do sol passe através dele. As impurezas escuras no gelo de azoto ou nas rochas mais escuras abaixo do gelo aquecem ligeiramente sob a luz solar, derretendo e vaporizando o azoto sólido, que eventualmente rompe através do azoto sólido como géiseres que empurram partículas de gelo um a cinco milhas acima da superfície congelada de Triton.
O azoto do universo foi feito, e está a ser feito, pelo ciclo CNO em estrelas mais pesadas do que o nosso sol. (Ver imagem abaixo)
Nitrogénio e o ciclo CNO
Quando nasceu a primeira geração de estrelas do universo, estas continham apenas os elementos feitos no big bang: hidrogénio, hélio, e uma pequena quantidade de lítio.
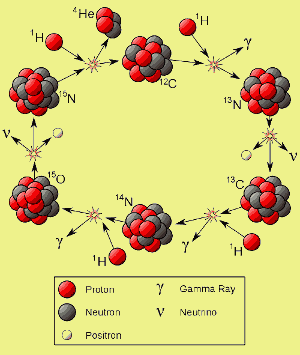 p>Clique aqui para ampliação. Imagem de Borb.
p>Clique aqui para ampliação. Imagem de Borb. Como estas estrelas queimadas, elas sintetizam elementos mais pesados, tais como o carbono. As supernovas espalharam então os elementos mais pesados em galáxias onde nasceram mais estrelas.
O carbono das supernovas desempenha um papel crucial na forma como muitas estrelas de segunda e maior geração queimam. Nas estrelas cuja massa é superior a cerca de 1,1 – 1,5 vezes a do nosso sol, o carbono-12 catalisa a fusão do hidrogénio ao hélio – ou seja, o carbono-12 participa na reacção de fusão, mas não é consumido por ela.
Como se pode ver à esquerda, o carbono-12 é regenerado no final de cada ciclo, cujo resultado líquido é que quatro núcleos de hidrogénio são consumidos e um núcleo de hélio é produzido. Esta reacção é denominada ciclo CNO.
Todos os ciclos, cada núcleo de carbono-12 pode participar num número muito grande de ciclos. Uma proporção de nitrogénio produzido durante o ciclo CNO escapa a novas reacções. No fim da vida de uma estrela, este azoto pode ser distribuído pela galáxia. No nosso sistema solar, o azoto de uma estrela que morreu há milhares de milhões de anos acabou por se tornar um elemento essencial nas proteínas e no ADN e formou cerca de 80 por cento da atmosfera do nosso planeta.

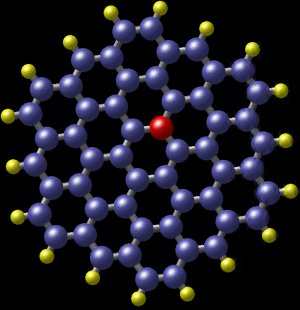
Um hidrocarboneto aromático policíclico com azoto. As bolas azuis são átomos de carbono e as bolas amarelas são átomos de hidrogénio. A bola vermelha mostra a posição de um átomo de azoto que cabe quase perfeitamente dentro da molécula. Esta molécula foi detectada na galáxia espiral M81, a cerca de 12 milhões de anos-luz da Terra. (Imagem: Nasa)
Aspecto e Características
Efeitos nocivos:
O azoto é não tóxico em condições normais.
O contacto directo da pele com azoto líquido causa fortes queimaduras por congelação.
Descompressão em mergulhadores ou astronautas pode causar as “curvas” – uma condição potencialmente fatal quando se formam bolhas de azoto na corrente sanguínea.
Características:
O azoto é um gás incolor, inodoro, insípido, diatómico e geralmente inerte à temperatura e pressão normais.
À pressão atmosférica, o nitrogénio é líquido entre 63 K e 77 K.
Líquidos mais frios do que este são consideravelmente mais caros do que o azoto líquido é.
Usos de azoto
O azoto é utilizado para produzir amoníaco (processo Haber) e fertilizantes, vitais para os métodos actuais de produção alimentar. Também é utilizado para fabricar ácido nítrico (processo Ostwald).
Na recuperação de petróleo, o nitrogénio de alta pressão é utilizado para forçar o petróleo bruto que de outra forma não seria recuperado dos poços de petróleo. As qualidades inertes do nitrogénio encontram utilização nas indústrias química e petrolífera para cobrir tanques de armazenamento com uma camada inerte de gás.
O nitrogénio líquido é utilizado como refrigerante. Os supercondutores para tecnologias práticas deveriam idealmente não ter resistência eléctrica a temperaturas superiores a 63 K, porque esta temperatura é atingível a um custo relativamente baixo utilizando nitrogénio líquido. As temperaturas mais baixas vêm com um preço muito mais elevado.
Embora o azoto elementar não seja muito reactivo, muitos dos compostos de azoto são instáveis.
Os óxidos formam-se naturalmente no aço durante a soldadura e estes enfraquecem a soldadura. O azoto pode ser utilizado para excluir o oxigénio durante a soldadura, resultando em melhores soldaduras.
No mundo natural, o ciclo do azoto é de importância crucial para os organismos vivos. O nitrogénio é retirado da atmosfera e convertido em nitratos através de tempestades de raios e bactérias fixadoras de azoto. Os nitratos fertilizam o crescimento das plantas onde o nitrogénio se torna ligado em aminoácidos, ADN e proteínas. Pode então ser comido por animais. Eventualmente, o azoto das plantas e animais regressa ao solo e à atmosfera e o ciclo repete-se.
Abundância e isótopos
Abundância da crosta terrestre: 19 partes por milhão em peso, 28 partes por milhão por toupeiras
Abundância do sistema solar: 1.000 ppm em peso, 90 ppm por toupeiras
Custo, puro: $0,4 por 100g
Custo, a granel: $ por 100g
Fonte: Comercialmente, o azoto é obtido a partir do ar líquido por destilação fraccionada. A atmosfera terrestre contém na região de 4 quadriliões de toneladas (4 x 1015) de azoto.
Isótopos: O azoto tem 12 isótopos cujas meias-vidas são conhecidas, com números de massa de 11 a 19. O nitrogénio natural é uma mistura de dois isótopos, 14N e 15N com abundâncias naturais de 99,6% e 0,4% respectivamente.

- Alexander Findlay, Chemistry in the Service of Man., (2007) p46. Findlay Press.
- Aaron John Ihde, The Development of Modern Chemistry., (2007) p38. Dover Publications.
- Jonathan Shectman, Groundbreaking Scientific Experiments, Inventions, and Discoveries of the 18th Century., (2003) p78. Greenwood Publishing Group.
- Ida Freund, The Experimental Basis Of Chemistry – Suggestions For A Series Of Experiments Illustrative Of The Fundamental Principles Of Chemistry., (2007) p145. Caffin Press.
- George Wilson, The Life of Henry Cavendish., (1851) p28. The Cavendish Society. (pdf – download grande 31 MB).
- Royston M. Roberts, Serendipity, Accidental Discoveries in Science., (1989) p89. John Wiley and Sons.
Cite esta Página
Para ligação online, por favor copie e cole um dos seguintes:
<a href="https://www.chemicool.com/elements/nitrogen.html">Nitrogen</a>
ou
<a href="https://www.chemicool.com/elements/nitrogen.html">Nitrogen Element Facts</a>
Para citar esta página num documento académico, use por favor a seguinte citação conforme MLA:
"Nitrogen." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/nitrogen.html>.