Introdução à Ligação Química
Lewis diagramas para Compostos Moleculares/Iões
Para desenhar os diagramas de lewis para compostos moleculares ou iões, seguir estes passos abaixo (usaremos H2O como exemplo a seguir):
1) Contar o número de electrões de valência do composto molecular ou ião. Lembre-se, se houver dois ou mais do mesmo elemento, então terá de duplicar ou multiplicar por quantos átomos houver do número de electrões de valança. Siga o número do grupo numeral romano para ver o número correspondente de electrões de valança que existem para esse elemento.
Electrões de valança:
Oxygen (O)–Group VIA: portanto, existem 6 electrões de valança
Hidrogénio (H)–Group IA: portanto, existe 1 electrão de valança
NOTE: Existem DOIS átomos de hidrogénio, portanto multiplique 1 electrão de valância X 2 átomos
Total: 6 + 2 = 8 electrões de valância
2) Se a molécula em questão for um ião, lembre-se de adicionar ou subtrair o respectivo número de electrões ao total do passo 1.
Para iões, se o ião tiver uma carga negativa (ânion), adicionar o número correspondente de electrões ao número total de electrões (isto é, se NO3- tiver uma carga negativa de 1-, então adiciona-se 1 electrão extra ao total; 5 + 3(6)= 23 +1 = 24 electrões totais). A – sinal significa que a molécula tem uma carga global negativa, pelo que deve ter este electrão extra. Isto porque os ânions têm uma maior afinidade com os electrões (tendência para ganhar electrões). A maioria dos ânions é composta por não metais, que têm uma elevada electronegatividade.
Se o ião tiver uma carga positiva (catião), subtrair o número correspondente de electrões ao número total de electrões (ou seja, H3O+ tem uma carga positiva de 1+, pelo que se subtrai 1 electrão extra ao total; 6 + 1(3) = 9 – 1 = 8 electrões totais). Um sinal + significa que a molécula tem uma carga positiva global, pelo que lhe deve faltar um electrão. Os cátions são positivos e têm uma afinidade mais fraca dos electrões. São maioritariamente compostos de metais; os seus raios atómicos são maiores do que os não metálicos. Isto significa consequentemente que a blindagem é aumentada, e os electrões têm menos tendência a ser atraídos para o núcleo “blindado”.
Do nosso exemplo, a água é uma molécula neutra, portanto não é necessário adicionar ou subtrair electrões do total.
3) Escrever os símbolos dos elementos, certificando-se de que todos os átomos são contabilizados (ou seja, H2O, escrever O e 2 H de cada lado do oxigénio). Comece por adicionar ligações simples (1 par de electrões) a todos os átomos possíveis, certificando-se de que seguem a regra do octeto (com as excepções da regra do dueto e outros elementos acima mencionados).
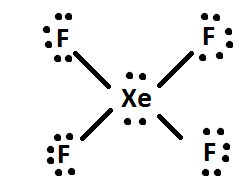
4) Se sobrar algum electrão, adicione-o ao átomo central da molécula (ou seja, XeF4 tem 4 electrões extra depois de ser distribuído, pelo que os 4 electrões extra são dados a Xe: assim. Finalmente, reordenar os pares de electrões em ligações duplas ou triplas se possível.