JOP. Journal of the Pancreas
Keywords
Adenocarcinoma, Mucinoso; Associação; Carcinoma, Intraductal, Não filtrante; Neoplasmas pancreáticos
INTRODUÇÃO
Carcinoma colóide do pâncreas, também conhecido como carcinoma mucinoso sólido ou gelatinoso, é um tumor que tem origem nos ductos pancreáticos, e foi recentemente reconhecido como uma entidade distinta. Representa apenas cerca de 1-3% de todos os carcinomas do pâncreas. A sua principal característica morfológica é a presença de poças bem circunscritas de material mucoso, contendo células epiteliais descoladas que flutuam na mucina .
Carcinoma colóide pancreático é considerado um subtipo distinto de neoplasia intraductal da mucosa papilar (IPMN); este facto é importante porque pode ditar o tratamento cirúrgico. Um diagnóstico diferencial entre o carcinoma coloidal e o adenocarcinoma ductal é essencial, porque as diferenças biológicas e moleculares entre estes tipos de tumor induzem uma evolução clínica mais indolente, um melhor resultado após o tratamento cirúrgico e uma maior taxa de sobrevivência do primeiro.
Este relato de caso descreve as características clínicas de um paciente com um carcinoma pancreático colóide invasivo localmente, o tratamento cirúrgico e o resultado.
RELATÓRIO DE CASO
Um homem de 64 anos, com antecedentes médicos de tensão arterial elevada e diabetes tipo 2 foi avaliado na nossa clínica ambulatorial devido a anemia. Também se queixou de dispepsia ligeira e de dores lombares baixas nos últimos 18 meses. Os testes de sangue convencionais mostraram anemia microcítica. Os marcadores tumorais eram normais, excepto para CA 19-9 203 U/mL (intervalo de referência: 0-39 U/mL). Uma tomografia computorizada (TC) contrastada do abdómen mostrou uma massa não homogénea de 12×7 cm, de baixa densidade, proveniente do corpo e da cauda do pâncreas. A massa invadiu a parede gástrica posterior, a flexão esplénica do cólon e o baço. A artéria mesentérica superior e o eixo celíaco não foram envolvidos; contudo, a artéria esplénica foi amputada na sua origem (Figura 1a). A conduta de Wirsung na cabeça do pâncreas foi aumentada (Figura 1b), com trombose da veia esplénica, hipertensão portal segmentar e varizes esofágicas.
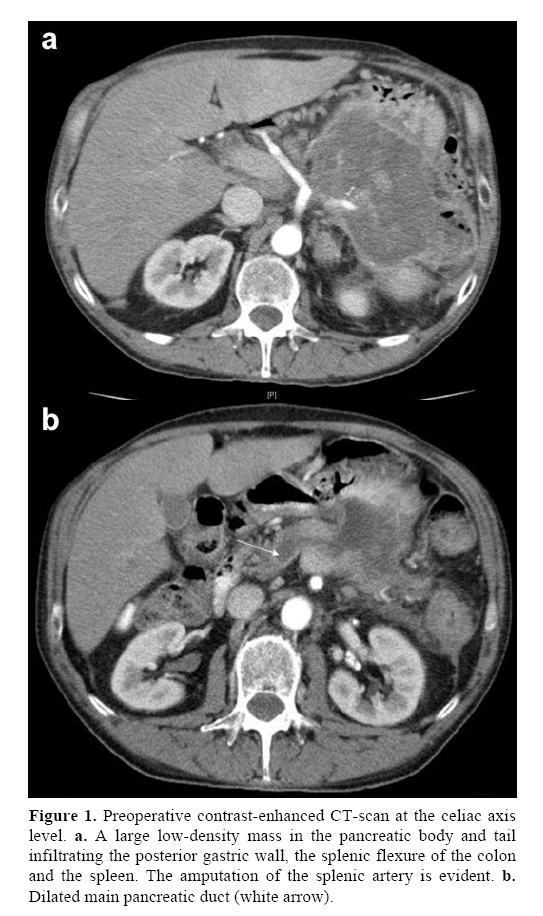
p>Figure 1. Tomografia computorizada de contraste pré-operatória ao nível do eixo celíaco. a. Uma grande massa de baixa densidade no corpo pancreático e infiltração da cauda na parede gástrica posterior, a flexão esplénica do cólon e do baço. A amputação da artéria esplénica é evidente. b. Canal pancreático principal dilatado (seta branca).
Biópsia por aspiração de agulha fina revelou uma neoplasia mucosa com atipia celular sugerindo malignidade. A CPRE não pôde ser realizada devido a um divertículo duodenal. Na laparotomia, foi observada uma grande massa retroperitoneal invadindo as estruturas circundantes. Foi realizada uma pancreatectomia distal com esplenectomia, gastrectomia total, ressecção de um segmento de cólon transversal e uma mancha de diafragma. As biópsias intra-operatórias da margem de transecção pancreática mostraram uma displasia de alto grau do ducto de Wirsung, pelo que foi realizada uma pancreatectomia completa. A reconstrução foi feita por uma esofagojejunostomia de Roux-Y e hepaticojejunostomia mais uma anastomose colocólica em T-T e fecho primário do diafragma esquerdo. O curso pós-operatório foi sem problemas, e o paciente teve alta no 12º dia pós-operatório.
O exame patológico da peça demonstrou um carcinoma coloidal do pâncreas, de 15 cm de diâmetro, invadindo localmente a parede gástrica posterior e o cólon transversal. As margens de ressecção retroperitoneal estavam livres de invasão. O exame microscópico encontrou poças de mucina com filas de células mucosas epiteliais mostrando atipias nucleares, e ocasionalmente adoptando um padrão glandular (Figura 2). Foi também observada a associação da IPMN com displasia de alto grau (carcinoma “in situ”) invadindo todo o ducto de Wirsung. Não houve invasão metastática em nenhum dos gânglios linfáticos recuperados. Após avaliação pela equipa multidisciplinar, não foi indicada quimioterapia adjuvante.

p>Figure 2. O exame histopatológico microscópico dos espécimes cirúrgicos mostrou as piscinas características de mucina com filas de células mucínicasepiteliais mostrando atipias nucleares, e ocasionalmente adoptando um padrão glandular (H&E; ampliação original x10).
No seguimento de dois anos, uma tomografia computorizada não demonstrou recidiva tumoral, e os marcadores tumorais, incluindo CA 19- 9, eram normais. O paciente permanece assintomático e tem uma excelente qualidade de vida 24 meses após o procedimento.
DISCUSSÃO
Carcinoma colóide do pâncreas é um tumor raro produtor de muco que deve ser considerado um tipo diferencial de tumor invasivo entre as neoplasias pancreáticas . É uma neoplasia bem caracterizada noutros órgãos, tais como mama, próstata ou cólon, com comportamento e prognóstico variáveis, dependendo dos critérios estabelecidos para o diagnóstico em cada órgão . No pâncreas, os carcinomas coloidais apresentam geralmente um comportamento clínico indolente, com um padrão de crescimento lento e melhor prognóstico quando comparados com os adenocarcinomas ductais, produzindo uma taxa de sobrevivência de 5 anos próxima de 60% em casos ressecáveis . O diagnóstico pré-operatório é de grande importância na orientação da gestão do paciente: graças aos avanços nas técnicas de imagem, os tumores pancreáticos podem ser detectados em fases iniciais e melhor definidos, a fim de planear uma abordagem cirúrgica precisa.
Os diferentes comportamentos clínicos revelados pelo carcinoma coloidal pancreático podem estar em parte relacionados com duas características deste tumor: a) a polaridade celular tumoral alterada encontrada no exame microscópico onde a superfície da célula estromal demonstra propriedades secretoras em vez da superfície da célula ductal; e b) o tipo de mucina secretada pelas células tumorais.
A produção de MUC2 é altamente específica no carcinoma coloidal enquanto que a MUC1 é secretada no adenocarcinoma . Tanto o MUC1 como o MUC2 parecem ter papéis importantes na neoplasia pancreática. O MUC1 parece ser um marcador de um fenótipo agressivo e pode facilitar a propagação vascular das células tumorais. Por outro lado, o MUC2 é comumente expresso em tumores com um curso indolente, tais como algumas IPMNs e especificamente em carcinomas coloidais envolvendo diferentes órgãos . Foi postulado que a secreção de MUC2 no estroma provoca a formação de uma camada gelatinosa de mucina em torno das células tumorais que limitaria a sua propagação metastática.
Ressecção cirúrgica, quando viável, é o tratamento de escolha nestes tumores . Uma vez que o carcinoma colóide pancreático apresenta um padrão de crescimento lento com invasão local em vez de doença disseminada, pode justificar-se uma abordagem cirúrgica radical, adaptada ao padrão de invasão local, a fim de realizar uma ressecção R0. Além disso, não há dados disponíveis sobre o papel da terapia neo-adjuvante para o carcinoma colóide pancreático localmente avançado, para diminuir a carga tumoral. Contudo, como mencionado acima, a ressecção R0 foi associada a uma sobrevida aceitável de 5 anos.
O diagnóstico específico do subtipo coloidal de IPMN pode ditar a extensão da pancreatectomia, uma vez que deixar IPMN no pâncreas remanescente pode colocar o doente em risco de recidiva . Foi realizada uma pancreatectomia total no nosso paciente devido à presença de nódulos dispersos encontrados no ducto remanescente de Wirsung que era histologicamente consistente com o IPMN com uma displasia de alto grau. O papel da terapia adjuvante em pacientes com carcinoma colóide pancreático não foi especificamente abordado. Quando se consegue uma ressecção R0, não há evidência clínica de que a terapia adjuvante não irá melhorar nem a sobrevivência nem as taxas de sobrevivência sem doença .
Em resumo, o carcinoma coloidal do pâncreas é um subtipo raro de IPMN que apresenta um curso clínico indolente e um padrão de invasão local. Uma abordagem cirúrgica radical pode ser preferida para se conseguir uma ressecção R0 que pode produzir uma sobrevida de 5 anos próxima de 60%. O diagnóstico de IPMN invasivo pode ditar a extensão da pancreatectomia. O papel da terapia adjuvante não foi elucidado.
Conflito de interesses
Os autores não têm potencial conflito de interesses
- Andea A, Klimstra D, Cheng J, et al. Carcinoma coloidal do pâncreas. Caminho de Diagnóstico da Moeda. 2004;10:61-68.
- Adsay N, Pierson C, Sarkar F, et al. Carcinoma colóide (Mucinous Noncystic) do pâncreas. Am J Surg Pathol.2001;25:26-42.
- Yopp AC, Katabi N, Janakos M, et al. Carcinoma Invasivo que surge em neoplasias mucosas papilares intraducais do pâncreas. Um estudo de controlo combinado com adenocacinoma pancreáticoductal convencional. Ann Surg 2011;253:968-974.
- Adsay NV, Merati K, Nassar H, et al. Patogénese de carcinoma coloidal (mucosa pura) de órgãos exócrinos: o acoplamento da produção de gelformingmucina (MUC2) com a alteração da polaridade celular e a interacção anormal do estroma celular pode ser o factor chave na morfogénese e no comportamento indolente do carcinoma coloidal no peito e no pâncreas. Am J Surg Pathol. 2003;27:571-578.
- Crippa S, Salvia R, Warshaw AL, et al. O cisticneoplasma mucoso do pâncreas não é uma entidade agressiva: lições de163 pacientes ressecados. Ann Surg. 2008;247:571-579.
li> Vo T, Xing Y, Meric-Bernstam F, et al. Resultados a longo prazo em Pacientes com carcinomas mucinosos, medulares, tubulares e ductais invasivos após a lumpectomia. Am J Surg. 2007;194:527-531.li> Waters JA, Schnelldorfer T, Aguilar-Saavedra JR, et al. Survival after resection for invasive intraductal mucinous neoplasmand for pancreatic adenocarcinoma: a multiinstitutional comparison according to American Joint Committee on Cancer Stage. J Am CollSurg 2011;213:275-283.li> Tanaka M, Chari S, Adsay V, et al. International consensus guidelines for management of intraductal papillary mucinousneoplasms and mucinous cystic neoplasms of the pancreas. Pâncreatologia. 2006;6:17-32.li> Levi E, Klimstra DS, Andea A, et al. MUC1 e MUC2 neoplasia inpancreática. J Clin Pathol. 2004;57:456-462.
li> Schnelldorfer T, Sarr MG, Nagorney DM, et al. Experiência com208 ressecções para neoplasia intraductal da mucosa papilífera do pâncreas. Arch Surg. 2008;143:639-646.
li> Turrini O, Waters JA, Schnelldorfer T, et al. Neoplasma invasivo intraductal da mucosa papilar: preditores de sobrevivência e papel da terapia adjuvante. HBP (Oxford). 2010;12(7):447-455.