Monossacarídeos
Com poucas excepções (por exemplo, desoxirribose), os monossacarídeos têm esta fórmula química: (CH2O)x, onde convencionalmente x ≥ 3. Os monossacáridos podem ser classificados pelo número x de átomos de carbono que contêm: triose (3), tetrose (4), pentose (5), hexose (6), heptose (7), e assim por diante.
Glucose, utilizada como fonte de energia e para a síntese de amido, glicogénio e celulose, é uma hexose. Ribose e deoxirribose (em RNA e DNA respectivamente) são açúcares pentose. Exemplos de heptoses incluem as cetoses, mannoheptulose e sedoheptulose. Monossacarídeos com oito ou mais carbonos são raramente observados, uma vez que são bastante instáveis. Em soluções aquosas, os monossacarídeos existem como anéis se tiverem mais de quatro carbonos.
Monossacarídeos de cadeia linearEditar
Monossacarídeos simples têm um esqueleto de carbono linear e não ramificado com um grupo funcional carbonilo (C=O), e um grupo hidroxilo (OH) em cada um dos restantes átomos de carbono. Portanto, a estrutura molecular de um monossacarídeo simples pode ser escrita como H(CHOH)n(C=O)(CHOH)mH, onde n + 1 + m = x; de modo que a sua fórmula elementar é CxH2xOx.
Por convenção, os átomos de carbono são numerados de 1 a x ao longo da espinha dorsal, começando a partir do fim que está mais próximo do grupo C=O. Os monossacáridos são as unidades mais simples de hidratos de carbono e a forma mais simples de açúcar.
Se o carbonilo estiver na posição 1 (ou seja, n ou m é zero), a molécula começa com um grupo formílico H(C=O)- e é tecnicamente um aldeído. Nesse caso, o composto é denominado uma aldose. Caso contrário, a molécula tem um grupo keto, um carbonilo -(C=O)- entre dois carbonos; depois é formalmente uma cetona, e é denominada uma cetose. As cetoses de interesse biológico têm geralmente o carbonilo na posição 2.
As várias classificações acima podem ser combinadas, resultando em nomes como “aldohexose” e “ketotriose”.
Uma nomenclatura mais geral para monossacarídeos de cadeia aberta combina um prefixo grego para indicar o número de carbonos (tri-, tetr-, pent-, hex-, etc.) com os sufixos “-ose” para aldoses e “-ulose” para cetoses. Neste último caso, se o carbonilo não estiver na posição 2, a sua posição é então indicada por um infixo numérico. Assim, por exemplo, H(C=O)(CHOH)4H é pentose, H(CHOH)(C=O)(CHOH)3H é pentulose, e H(CHOH)2(C=O)(CHOH)2H é pent-3-ulose.
Estereo-isómeros de cadeia abertaEditar
Dois monossacáridos com gráficos moleculares equivalentes (mesmo comprimento de cadeia e mesma posição carbonílica) podem ainda ser estereoisómeros distintos, cujas moléculas diferem na orientação espacial. Isto só acontece se a molécula contiver um centro estereogénico, especificamente um átomo de carbono que é quiral (ligado a quatro subestruturas moleculares distintas). Essas quatro ligações podem ter qualquer uma de duas configurações no espaço, distinguindo-se pela sua mão. Num simples monossacarídeo de cadeia aberta, todo o carbono é quiral excepto o primeiro e o último átomos da cadeia, e (em cetoses) o carbono com o grupo keto.
Por exemplo, a triketose H(CHOH)(C=O)(CHOH)H (glicerona, dihidroxiacetona) não tem centro estereogénico, e portanto existe como um único estereoisómero. Os outros triose, a aldose H(C=O)(CHOH)2H (gliceraldeído), tem um carbono quiral – o central, número 2 – que está ligado aos grupos -H, -OH, -C(OH)H2, e -(C=O)H. Por conseguinte, existe como dois estereoisómeros cujas moléculas são imagens espelhadas uma da outra (como uma luva esquerda e uma direita). Os monossacarídeos com quatro ou mais carbonos podem conter múltiplos carbonos quirais, pelo que têm tipicamente mais de dois estereoisómeros. O número de estereoisómeros distintos com o mesmo diagrama é limitado por 2c, onde c é o número total de carbonos quirais.
A projecção Fischer é uma forma sistemática de desenhar a fórmula esquelética de um monossacarídeo acíclico, de modo a que a mão de cada carbonos quirais seja bem especificada. Cada estereoisómero de um simples monossacarídeo de cadeia aberta pode ser identificado pelas posições (direita ou esquerda) no diagrama Fischer dos hidroxilos quirais (os hidroxilos ligados aos carbonos quirais).
Os principais estereoisómeros são eles próprios quirais (distintos das suas imagens espelhadas). Na projecção de Fischer, dois isómeros de imagem-espelho diferem ao terem as posições de todos os hidroxilos quirais invertidas da direita para a esquerda. Os isómeros de imagem-espelho são quimicamente idênticos em ambientes não quirais, mas geralmente têm propriedades bioquímicas e ocorrências muito diferentes na natureza.
Embora a maioria dos estereoisómeros possam ser dispostos em pares de formas de imagem-espelho, existem alguns estereoisómeros não quirais que são idênticos às suas imagens-espelho, apesar de terem centros quirais. Isto acontece sempre que o gráfico molecular é simétrico, como nos 3ketopentoses H(CHOH)2(CO)(CHOH)2H, e as duas metades são imagens espelhadas uma da outra. Nesse caso, o espelhamento é equivalente a uma rotação de meia volta. Por esta razão, existem apenas três estereoisómeros de 3-ketopentose distintos, embora a molécula tenha dois carbonos quirais.
Estéreoisómeros distintos que não são estereoisómeros espelhados um do outro têm geralmente propriedades químicas diferentes, mesmo em ambientes não quirais. Portanto, a cada par de espelhos e a cada estereoisómero não quiral pode ser dado um nome específico de monossacarídeo. Por exemplo, existem 16 estereoisómeros de aldohexos distintos, mas o nome “glucose” significa um par específico de aldohexos de imagem-espelho. Na projecção de Fischer, um dos dois isómeros de glucose tem o hidroxilo à esquerda em C3, e à direita em C4 e C5; enquanto o outro isómero tem o padrão inverso. Estes nomes específicos de monossacarídeos têm abreviaturas convencionais de três letras, como “Glu” para a glucose e “Thr” para os três.
Geralmente, um monossacarídeo com n carbonos assimétricos tem 2n estereoisómeros. O número de estereoisómeros de cadeia aberta para um monossacarídeo de aldose é maior por um do que o de um monossacarídeo de cetose do mesmo comprimento. Cada cetose terá 2(n-3) estereoisómeros onde n > 2 é o número de carbonos. Cada aldose terá 2(n-2) estereoisómeros onde n > 2 é o número de carbonos. Estes também são referidos como epimérios que têm a disposição diferente dos grupos -OH e -H nos átomos de carbono assimétricos ou quirais (isto não se aplica aos carbonos que têm o grupo funcional carbonilo).
Configuração de monossacarídeosEdit
Como muitas moléculas quirais, os dois estereoisómeros de gliceraldeído rodarão gradualmente a direcção de polarização da luz linearmente polarizada à medida que esta passa por ela, mesmo em solução. Os dois estereoisómeros são identificados com os prefixos D- e L-, de acordo com o sentido de rotação: D-gliceraldeído é dextrorotatório (roda o eixo de polarização no sentido horário), enquanto L-gliceraldeído é levorotatório (roda-o no sentido anti-horário).

Os prefixos D- e L- são também utilizados com outros monossacáridos, para distinguir dois estereoisómeros particulares que são imagens-espelho um do outro. Para este efeito, considera-se o carbono quiral que é mais afastado do grupo C=O. As suas quatro ligações devem ligar-se a -H, -OH, -C(OH)H, e ao resto da molécula. Se a molécula puder ser rodada no espaço para que as direcções desses quatro grupos coincidam com as dos grupos analógicos no grupo D-gliceraldeído C2, então o isómero recebe o prefixo D-. Caso contrário, recebe o prefixo L-.
Na projecção de Fischer, os prefixos D- e L- especificam a configuração no átomo de carbono que é o segundo a partir do fundo: D- se o hidroxilo estiver do lado direito, e L- se estiver do lado esquerdo.
Nota que os prefixos D- e L- não indicam a direcção de rotação da luz polarizada, o que é um efeito combinado da disposição em todos os centros quirais. No entanto, os dois enantiómeros irão sempre rodar a luz em direcções opostas, pela mesma quantidade. Ver também sistema D/L.
Ciclização de monossacarídeosEditar
Um monossacarídeo muda frequentemente da forma acíclica (de cadeia aberta) para uma forma cíclica, através de uma reacção de adição nucleofílica entre o grupo carbonilo e um dos hidroxilos da mesma molécula. A reacção cria um anel de átomos de carbono fechado por um átomo de oxigénio em ponte. A molécula resultante tem um grupo hemiacetal ou hemiketal, dependendo se a forma linear foi uma aldose ou uma cetose. A reacção é facilmente invertida, produzindo a forma original de cadeia aberta.
Nestas formas cíclicas, o anel tem geralmente cinco ou seis átomos. Estas formas são chamadas furanoses e pyranoses, respectivamente – por analogia com furano e pyran, os compostos mais simples com o mesmo anel de oxigénio-carbono (embora lhes faltem as ligações duplas destas duas moléculas). Por exemplo, a glucose aldohexosa pode formar uma ligação hemiaxietal entre o hidroxil no carbono 1 e o oxigénio no carbono 4, produzindo uma molécula com um anel de 5 membros, chamada glucofuranose. A mesma reacção pode ocorrer entre os carbonos 1 e 5 para formar uma molécula com um anel de 6 membros, chamada glucopiranose. As formas cíclicas com um anel de sete átomos (o mesmo do oxepano), raramente encontradas, são chamadas heptoses.

>div>
/div>
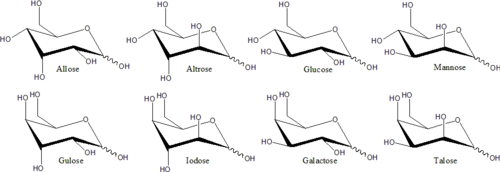
Para muitos monossacarídeos (incluindo a glucose), as formas cíclicas predominam, no estado sólido e em soluções, e por isso o mesmo nome é comummente usado para os isómeros de cadeia aberta e fechada. Assim, por exemplo, o termo “glucose” pode significar glucofuranose, glucopiranose, a forma de cadeia aberta, ou uma mistura dos três.
Ciclização cria um novo centro estereogénico no carbono portador de carbonilo. O grupo -OH que substitui o oxigénio do carbonilo pode acabar em duas posições distintas em relação ao plano médio do anel. Assim, cada monossacarídeo de cadeia aberta produz dois isómeros cíclicos (anomalias), denotados pelos prefixos α- e β-. A molécula pode mudar entre estas duas formas através de um processo chamado mutarotação, que consiste numa inversão da reacção de formação do anel seguida de outra formação do anel.
projecção HaworthEdit
A estrutura estereoquímica de um monossacarídeo cíclico pode ser representada numa projecção Haworth. Neste diagrama, o isómero α para a forma de piranose de um D-aldohexose tem o -OH do carbono anomérico abaixo do plano dos átomos de carbono, enquanto que o isómero β tem o -OH do carbono anomérico acima do plano. As piranoses normalmente adoptam uma conformação de cadeira, semelhante à do ciclohexano. Nesta conformação, o isómero α tem o -OH do carbono anomérico em posição axial, enquanto que o isómero β tem o -OH do carbono anomérico em posição equatorial (considerando os açúcares D-aldohexose).
-
α-D-Glucopiranose
-
β-D-Glucopiranose