O Prémio Nobel Logotipo do Prémio Nobel
Inglês
Inglês (pdf)
Sueco
![]()
p> A Assembleia Nobel no Karolinska Institutet decidiu hoje prémio
o Prémio Nobel de Fisiologia ou Medicina de 2016
para
p>Yoshinori Ohsumi
para as suas descobertas de mecanismos de autofagia
Sumário
O Prémio Nobel deste ano descobriu e elucidou mecanismos subjacentes à autofagia, um processo fundamental para degradar e reciclar componentes celulares.
A palavra autofagia tem origem nas palavras gregas auto, que significa “self”, e phagein, que significa “comer”. Assim, autofagia denota “auto-comer”. Este conceito surgiu durante os anos 60, quando os investigadores observaram pela primeira vez que a célula podia destruir o seu próprio conteúdo, encerrando-o em membranas, formando vesículas em forma de saco que eram transportadas para um compartimento de reciclagem, chamado lisossoma, para se degradarem. As dificuldades em estudar o fenómeno fizeram com que pouco se soubesse até que, numa série de experiências brilhantes no início dos anos 90, Yoshinori Ohsumi utilizou levedura de padeiro para identificar genes essenciais para a autofagia. Em seguida, prosseguiu elucidando os mecanismos subjacentes à autofagia em levedura e mostrou que nas nossas células é utilizada maquinaria sofisticada semelhante.
As descobertas de Ohsumi levaram a um novo paradigma na nossa compreensão de como a célula recicla o seu conteúdo. As suas descobertas abriram o caminho para a compreensão da importância fundamental da autofagia em muitos processos fisiológicos, tais como na adaptação à fome ou na resposta a infecções. Mutações nos genes da autofagia podem causar doenças, e o processo autofágico está envolvido em várias condições, incluindo cancro e doenças neurológicas.
Degradação – uma função central em todas as células vivas
Em meados dos anos 50, os cientistas observaram um novo compartimento celular especializado, chamado organela, contendo enzimas que digerem proteínas, hidratos de carbono e lípidos. Este compartimento especializado é referido como um “lisossoma” e funciona como uma estação de trabalho para a degradação dos constituintes celulares. O cientista belga Christian de Duve recebeu o Prémio Nobel de Fisiologia ou Medicina em 1974 pela descoberta do lisossoma. Novas observações durante a década de 1960 mostraram que grandes quantidades de conteúdo celular, e mesmo organelas inteiras, podiam por vezes ser encontradas dentro de lisossomas. A célula parecia, portanto, ter uma estratégia de entrega de grandes cargas ao lisossoma. Outras análises bioquímicas e microscópicas revelaram um novo tipo de vesícula transportando a carga celular para o lisossoma para degradação (Figura 1). Christian de Duve, o cientista por detrás da descoberta do lisossoma, cunhou o termo autofagia, “comendo-se a si próprio”, para descrever este processo. As novas vesículas foram nomeadas autophagosomes.
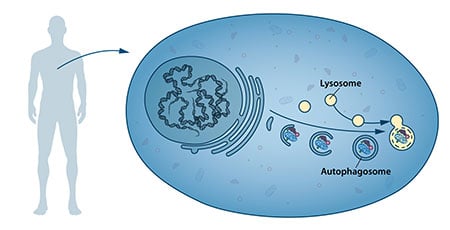
p>Durante os anos 70 e 80, os investigadores concentraram-se na elucidação de outro sistema utilizado para degradar proteínas, nomeadamente o “proteasoma”. Dentro deste campo de investigação Aaron Ciechanover, Avram Hershko e Irwin Rose receberam o Prémio Nobel da Química de 2004 pela “descoberta da degradação proteica mediada pela ubiquitina”. O proteasoma degrada eficazmente as proteínas uma a uma, mas este mecanismo não explicou como a célula se livrou de complexos proteicos maiores e organelas desgastadas. Poderia o processo de autofagia ser a resposta e, se assim fosse, quais seriam os mecanismos?
Uma experiência inovadora
Yoshinori Ohsumi tinha estado activo em várias áreas de investigação, mas ao iniciar o seu próprio laboratório em 1988, concentrou os seus esforços na degradação proteica no vacuole, uma organela que corresponde ao lisossoma em células humanas. As células de levedura são relativamente fáceis de estudar e, consequentemente, são frequentemente utilizadas como modelo para células humanas. São particularmente úteis para a identificação de genes que são importantes em vias celulares complexas. Mas Ohsumi enfrentou um grande desafio; as células de levedura são pequenas e as suas estruturas internas não se distinguem facilmente sob o microscópio, pelo que não sabia se a autofagia existia sequer neste organismo. Ohsumi argumentou que se ele pudesse perturbar o processo de degradação no vacúolo enquanto o processo de autofagia estivesse activo, então os autofagosomas deveriam acumular-se dentro do vacúolo e tornar-se visíveis sob o microscópio. Assim, ele cultivou leveduras mutantes sem enzimas de degradação vacuolares e estimulou simultaneamente a autofagia através da fome das células. Os resultados foram impressionantes! Em poucas horas, os vacúolos foram preenchidos com pequenas vesículas que não tinham sido degradadas (Figura 2). As vesículas eram autofagosomas e a experiência de Ohsumi provou que a autofagia existe nas células de levedura. Mas ainda mais importante, ele tinha agora um método para identificar e caracterizar os genes-chave envolvidos neste processo. Este foi um grande avanço e Ohsumi publicou os resultados em 1992.

Genes de autofagia são descobertos
Ohsumi tirou agora partido das suas estirpes de levedura artificial em que os autofagosomas se acumularam durante a fome. Esta acumulação não deveria ocorrer se genes importantes para a autofagia estivessem inactivados. Ohsumi expôs as células de levedura a um químico que introduziu mutações aleatórias em muitos genes, e depois induziu a autofagia. A sua estratégia funcionou! Um ano após a sua descoberta da autofagia em levedura, Ohsumi tinha identificado os primeiros genes essenciais para a autofagia. Na sua série subsequente de elegantes estudos, as proteínas codificadas por estes genes foram funcionalmente caracterizadas. Os resultados mostraram que a autofagia é controlada por uma cascata de proteínas e complexos proteicos, cada um regulando uma fase distinta de iniciação e formação do autofagosoma (Figura 3).
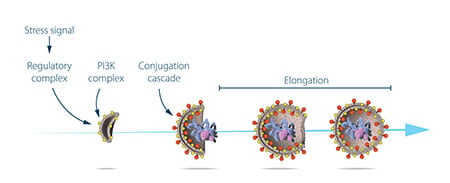
Autofagia – um mecanismo essencial nas nossas células
Após a identificação do mecanismo de autofagia em levedura, uma questão-chave permaneceu. Havia um mecanismo correspondente para controlar este processo noutros organismos? Logo se tornou claro que mecanismos virtualmente idênticos operam nas nossas próprias células. Os instrumentos de investigação necessários para investigar a importância da autofagia em humanos estavam agora disponíveis.
Abrigado a Ohsumi e outros seguindo os seus passos, sabemos agora que a autofagia controla importantes funções fisiológicas onde os componentes celulares precisam de ser degradados e reciclados. A autofagia pode fornecer rapidamente combustível para energia e blocos de construção para renovação de componentes celulares, e é portanto essencial para a resposta celular à fome e a outros tipos de stress. Após a infecção, a autofagia pode eliminar bactérias e vírus intracelulares invasores. A autofagia contribui para o desenvolvimento embrionário e diferenciação celular. As células também utilizam a autofagia para eliminar proteínas e organelas danificadas, um mecanismo de controlo de qualidade que é crítico para contrariar as consequências negativas do envelhecimento.
A autofagia interrompida tem sido ligada à doença de Parkinson, à diabetes tipo 2 e a outras doenças que aparecem nos idosos. As mutações nos genes da autofagia podem causar doenças genéticas. Perturbações na máquina autofágica também têm sido ligadas ao cancro. Actualmente, está em curso uma intensa investigação para desenvolver medicamentos que possam visar a autofagia em várias doenças.
Autofagia é conhecida há mais de 50 anos mas a sua importância fundamental em fisiologia e medicina só foi reconhecida depois da investigação de Yoshinori Ohsumi sobre a mudança de paradigma na década de 1990. Pelas suas descobertas, ele é galardoado este ano com o Prémio Nobel em fisiologia ou medicina.
Key publications
Takeshige, K., Baba, M., Tsuboi, S., Noda, T. e Ohsumi, Y. (1992). Autofagia em levedura demonstrada com mutantes deficientes em proteinas e condições para a sua indução. Journal of Cell Biology 119, 301-311
Tsukada, M. e Ohsumi, Y. (1993). Isolamento e caracterização de mutantes autofágicos defeituosos de Saccharomyces cervisiae. FEBS Letters 333, 169-174
Mizushima, N., Noda, T., Yoshimori, T., Tanaka, Y., Ishii, T., George, M.D., Klionsky, D.J., Ohsumi, M. e Ohsumi, Y. (1998). Um sistema de conjugação de proteínas essencial para a autofagia. Nature 395, 395-398
Ichimura, Y., Kirisako T., Takao, T., Satomi, Y., Shimonishi, Y., Ishihara, N., Mizushima, N., Tanida, I., Kominami, E., Ohsumi, M., Noda, T. e Ohsumi, Y. (2000). Um sistema semelhante ao da ubiquitina medeia a lipidação das proteínas. Nature, 408, 488-492
Yoshinori Ohsumi nasceu em 1945 em Fukuoka, Japão. Recebeu um doutoramento da Universidade de Tóquio em 1974. Após ter passado três anos na Universidade Rockefeller, Nova Iorque, EUA, regressou à Universidade de Tóquio, onde estabeleceu o seu grupo de investigação em 1988. É desde 2009 professor no Instituto de Tecnologia de Tóquio.
A Assembleia Nobel, composta por 50 professores no Karolinska Institutet, atribui o Prémio Nobel em Fisiologia ou Medicina. O seu Comité Nobel avalia as nomeações. Desde 1901 o Prémio Nobel tem sido atribuído a cientistas que fizeram as descobertas mais importantes em benefício da humanidade.
Prémio Nobel® é a marca registada da Fundação Nobel