Pneumonia Nosocomial
(Este capítulo foi reimpresso com permissão de Williams MV, Hayward R: Comprehensive Hospital Medicine, 1ª edição. Philadelphia, WB Saunders, no prelo.)
Background
Pneumonia Nosocomial (NP) é a principal causa de mortalidade entre os pacientes que morrem de infecções nosocomiais. Definida como pneumonia que ocorre 48 horas ou mais após a admissão hospitalar, NP também inclui o subconjunto de pneumonia associada a ventilação mecânica (PAV), definida como pneumonia que se desenvolve 48 a 72 horas após o início da ventilação mecânica. A incidência de NP situa-se entre 5 e 15 casos por 1000 admissões hospitalares. A pneumonia associada aos cuidados de saúde (HCAP), parte do continuum do NP, descreve uma proporção cada vez mais comum de pneumonia que se desenvolve fora do hospital (Quadro I) (1). Tipicamente afligindo pessoas num lar de idosos ou num ambiente de vida assistida, estes doentes estão em risco de contrair antibióticos – organismos resistentes e devem ser abordados de forma semelhante aos casos de pneumonia nosocomial e não de pneumonia adquirida na comunidade. A maioria dos dados que informam as nossas decisões de diagnóstico e tratamento sobre NP provém de estudos realizados em doentes com ventilação mecânica e são extrapolados para fazer recomendações para doentes não ventilados.
Mortalidade atribuível a NP é debatida, mas pode atingir os 30%. A presença de pneumonia nosocomial aumenta a duração média da hospitalização de 7-10 dias, e no caso de PAV, estima-se que o custo varie entre $10.000 e $40.000 por caso (2).
Avaliação
Apresentação Clínica
>P> Sinais e Sintomas
p>P>Pneumonia nosocomial é geralmente diagnosticada com base em fundamentos clínicos. Os sintomas e sinais típicos consistem em febre, tosse com expectoração, e falta de ar no quadro de hipoxia e um novo infiltrado na radiografia de tórax (CXR). Nos idosos, os sinais podem ser mais subtis e delírios, febre, ou leucocitose na ausência de tosse devem desencadear a sua consideração. A probabilidade de NP aumentar entre doentes com factores de risco de microaspiração, colonização orofaríngea, ou crescimento excessivo de organismos resistentes (Tabela II) (3).
Diagnóstico diferencial
P>Prior a estabelecer um diagnóstico de NP, devem ser consideradas causas alternativas de febre, hipoxia, e infiltrados pulmonares. Mais frequentemente, estas incluem embolia pulmonar, edema pulmonar, ou atelectasia. Fontes infecciosas alternativas, tais como infecções do tracto urinário, da pele e dos tecidos moles, e infecções relacionadas com dispositivos (ou seja, cateteres venosos centrais) são comuns em doentes hospitalizados e devem ser excluídas antes de diagnosticar pneumonia nosocomial.
 clique para versão grande
clique para versão grande
/div>
h3>Diagnóstico
Estratégias de diagnóstico para NP procuram confirmar o diagnóstico e identificar um patogénico etiológico, permitindo assim uma terapêutica antibiótica atempada, eficaz e racionalizada. Infelizmente, não existe consenso sobre a melhor abordagem para o diagnóstico da pneumonia nosocomial. Após a obtenção de um hemograma completo e de culturas de sangue, pode-se escolher entre uma abordagem de diagnóstico clínico ou microbiológico para o diagnóstico. Um diagnóstico clínico depende de um novo ou progressivo infiltrado radiográfico juntamente com sinais de infecção como febre, leucocitose, ou expectoração purulenta. O diagnóstico clínico é sensível, mas é provável que conduza a uma utilização excessiva de antibióticos. A abordagem microbiológica requer a amostragem de secreções das vias respiratórias e pode reduzir a utilização inadequada de antibióticos, mas demora mais tempo e pode não estar disponível em todos os hospitais.
Estudos prévios
A abordagem microbiológica do diagnóstico baseia-se na utilização de culturas quantitativas ou semi-quantitativas para criar limiares para o tratamento antibiótico. As culturas bacterianas que demonstram um nível de crescimento acima dos limiares descritos abaixo justificam tratamento, enquanto que as que se encontram abaixo devem desencadear a retenção ou descontinuação dos antibióticos.
Abordagens broncoscópicas: Lavagem broncoalveolar (BAL) com um corte de 10 (4) organismos/mL ou escova de espécimes protegida (PSB) com um corte de 10 (3) organismos/mL são considerados os testes de diagnóstico mais específicos quando realizados antes de iniciar o tratamento com antibióticos, ou antes da mudança de antibióticos se um paciente já os estiver a receber. Em pacientes clinicamente estáveis, os antibióticos podem ser descontinuados em segurança se o crescimento bacteriano cair abaixo dos limiares. Se as culturas forem positivas, a antibioticoterapia deve ser adaptada de modo a visar o organismo identificado. A abordagem broncoscópica é favorecida em pacientes que são ventilados mecanicamente, desenvolvem a sua pneumonia tardiamente na estadia hospitalar (>5-7 dias), correm o risco de patogénicos invulgares, estão a falhar a terapia ou suspeitam de ter um diagnóstico alternativo.
Abordagens não-broncoscópicas: Os aspirados endotraqueais qualitativos (ETA) demonstraram ser bastante sensíveis em doentes ventilados, identificam regularmente organismos que podem ser subsequentemente encontrados por BAL ou PSB, e se negativos, devem resultar na retenção de antibióticos. Os aspirados endotraqueais quantitativos com um corte de 10 (6) organismos/mL são frequentemente encorajados a reduzir o uso excessivo de antibióticos, mas os resultados devem ser interpretados cautelosamente, uma vez que têm apenas uma sensibilidade e especificidade de cerca de 75% (1). Deve ser considerada a retenção de antibióticos num doente clinicamente estável com uma ETA quantitativa negativa se os antibióticos não tiverem sido alterados nas 72 horas anteriores. Muitas UCIs começaram a realizar amostragens cegas de secreções do tracto respiratório inferior com cateteres de sucção (PSB cego, mini-BAL cego). Estas técnicas podem ser realizadas a qualquer hora por terapeutas respiratórios ou enfermeiros treinados, fornecem dados de cultura semelhantes aos da broncoscopia, e podem ser mais seguras e menos dispendiosas do que a broncoscopia. Em geral, as técnicas não broncoscópicas são preferidas em pacientes que não são ventilados mecanicamente. A amostragem de espuma, embora fácil de obter, não tem sido bem estudada em NP. No entanto, em pacientes em que as técnicas broncoscópicas ou outras técnicas não broncoscópicas não são viáveis, a amostragem da expectoração pode ser realizada para identificar organismos potencialmente resistentes e ajudar a terapia à medida.
Opções Alternativas
Classificação da Infecção Pulmonar Clínica-Combinação de Abordagens Clínicas e Microbiológicas
O diagnóstico clínico de pneumonia nosocomial (novo infiltrado + febre, leucocitose, ou expectoração purulenta) leva provavelmente a uma utilização excessiva de antibióticos, mas a procura de um diagnóstico broncoscópico é invasiva, dispendiosa, e requer conhecimentos técnicos especializados. A ETA quantitativa, o PSB cego, e o BAL cego discutidos acima são exemplos de alguns compromissos que evitam a necessidade de broncoscopia, mas acrescentam dados microbiológicos numa tentativa de prevenir o excesso de terapia antibiótica. A combinação formal de abordagens de diagnóstico (clínico + microbiológico) também pode ser útil. Uma dessas opções é a utilização da pontuação de infecção pulmonar clínica (CPIS), que combina dados clínicos, radiográficos, fisiológicos, e microbiológicos num resultado numérico. As pontuações >6 mostraram correlacionar bem com o BAL quantitativo (4). Estudos mais recentes, contudo, sugeriram uma menor especificidade que poderia ainda resultar numa utilização excessiva de antibióticos, mas esta abordagem continua a ser mais precisa do que uma abordagem clínica geral. A utilização do CPIS em série na altura em que se suspeita da NP e novamente às 72 horas pode ser mais útil. Os doentes com uma suspeita clínica inicial baixa de pneumonia (CPIS de 6 ou menos) poderiam ter os antibióticos descontinuados com segurança às 72 horas, se o CPIS se mantiver baixo (5). Tal estratégia pode ser útil em ambientes onde não existem modalidades de diagnóstico mais sofisticadas.
Estudos múltiplos de marcadores biológicos de infecção tentaram encontrar um meio não invasivo, rápido e preciso de determinar quem precisa de antibióticos para o presumível NP. Infelizmente, os resultados têm sido largamente decepcionantes. Mais recentemente, a medição de um receptor desencadeador solúvel expresso em células mielóides (sTREM-1) que não está impregnado no cenário da infecção demonstrou melhorar a nossa capacidade de diagnosticar o NP com precisão. A medição do sTREM-1 foi 98% sensível e 90% específica para o diagnóstico de pneumonia em pacientes ventilados mecanicamente (6). Embora promissor, são necessários mais dados antes que este teste possa ser recomendado para utilização de rotina.
Gestão
Tratamento Inicial
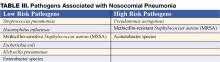
Início precoce de terapia antibiótica empírica adequada (ou seja, os antibióticos administrados mostram-se activos contra todos os organismos isolados) está associado a uma melhor sobrevivência em comparação com a terapia inicial inadequada (1,7). Os antibióticos devem ser iniciados imediatamente após a obtenção de amostras de sangue e expectoração para cultura e não devem ser retidos em caso de atraso nos testes de diagnóstico. A necessidade de escolher antibióticos de forma rápida e expedita impulsiona a utilização de antibióticos de largo espectro. Num esforço para evitar o uso excessivo desnecessário de antibióticos de largo espectro, a terapia deve basear-se no risco de agentes patogénicos multirresistentes (MDR). A identificação de doentes com baixo risco de agentes patogénicos MDR por critérios clínicos permite uma terapia antibiótica mais estreita, mas eficaz. Os doentes de baixo risco incluem aqueles que desenvolvem a sua pneumonia no início da hospitalização (<5-7 dias), não são imunocomprometidos, não tiveram antibióticos anteriores de largo espectro, e não têm factores de risco para HCAP (Tabela I) (1,7). Nestes doentes, os antibióticos devem visar organismos comuns adquiridos na comunidade (Quadro III – agentes patogénicos de baixo risco). A terapia antibiótica inicial apropriada poderia incluir uma terceira geração de cefalosporina ou um inibidor de beta-lactam/beta-lactamase. Em algumas comunidades ou enfermarias hospitalares, a incidência de resistência à meticilina entre os isolados de Staphylococcus aureus (MRSA) pode ser suficientemente elevada para justificar uma terapia empírica inicial com vancomicina ou linezolida.
 clique para versão grande
clique para versão grande
p>felizmente, é pouco provável que os pacientes hospitalizados de hoje, cada vez mais complexos, sejam “de baixo risco”, especialmente em unidades de cuidados intensivos.
Os doentes que não satisfazem os critérios de baixo risco são considerados de alto risco para os agentes patogénicos MDR (Quadro III – agentes patogénicos de alto risco). A terapia empírica inicial precisa de ser ampla e deve incluir um agente antipseudomonal (cefepime ou imipenem ou beta-lactam/beta-lactamase inibidor) mais uma fluoroquinolona ou aminoglicosídeo mais vancomicina ou linezolida. A terapia empírica inicial específica deve ser ditada pelos padrões locais de resistência, custo e disponibilidade dos agentes preferidos. Quando uma terapia de tão largo espectro é iniciada, torna-se imperativo que os antibióticos sejam “desescalados” para limitar o uso excessivo de antibióticos. A terapia de desescalonamento centra-se no estreitamento do espectro dos antibióticos com base nos resultados da cultura, e na limitação da duração global da terapia. Os internistas devem procurar realizar essa desescalonamento dentro de 48-72 horas após o início da antibioticoterapia de largo espectro.
 clique para versão grande
clique para versão grande
/div>
h3>Subsequente Tratamento
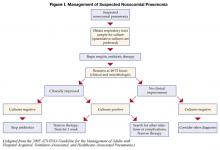
As doentes iniciaram a terapêutica empírica inicial com antibióticos para a pneumonia nosocomial presumida devem ser reavaliadas às 48-72 horas. Especificamente, as culturas devem ser verificadas e a resposta clínica ao tratamento deve ser avaliada. A figura I descreve um algoritmo para orientar o tratamento (1). Em doentes clinicamente estáveis e com culturas negativas do tracto respiratório inferior, os antibióticos podem ser interrompidos. Os doentes com culturas positivas devem ter antibióticos adaptados, ou “desescalonados” com base nos organismos identificados. Em geral, deve ser utilizado o antibiótico de espectro mais estreito que é activo contra as bactérias isoladas. A utilização de terapia combinada para organismos gram negativos (dois ou mais antibióticos activos contra um isolado bacteriano) é amplamente praticada para obter sinergia, ou impedir o desenvolvimento de resistência. No entanto, na ausência de neutropenia, a terapia combinada não demonstrou ser superior à monoterapia (8), e a monoterapia é preferível. O isolamento de MRSA a partir de uma amostra respiratória também deve resultar no uso de monoterapia. Embora alguns estudos tenham sugerido que a linezolida pode ser superior à vancomicina para a pneumonia por MRSA, esta descoberta precisa de validação em estudos prospectivos.
Um segundo componente de desescalonamento está a encurtar a duração total da terapia. O CPIS pode ser utilizado para encurtar a duração da terapia em doentes com baixo risco de pneumonia. Os investigadores de um centro médico Veterans Affairs randomizaram pacientes suspeitos de terem NP, mas que tinham uma pontuação CPIS < 6, quer para tratamento durante 10-21 dias, quer para terapia de curta duração. Os pacientes que receberam terapia de curso curto foram reavaliados no dia 3, e se a sua pontuação no CPIS se mantivesse < 6, os antibióticos foram interrompidos (5). O grupo de terapia de curso curto não tinha diferença na mortalidade quando comparado com o grupo de tratamento padrão, mas tinha menos uso de antibióticos, estadias mais curtas na UCI, e tinha menos probabilidades de desenvolver uma superinfecção ou infecção com um organismo resistente. Se o CPIS não for utilizado, ou se se sentir que os doentes estão em maior risco ou se se demonstrar convincentemente que têm NP, pode ainda assim ser preferível um tratamento mais curto. Um grande ensaio aleatório mostrou que 8 dias de terapia antibiótica para doentes com PAV resultaram em resultados clínicos semelhantes quando comparados com 15 dias de terapia. Além disso, a terapia antibiótica de menor duração foi associada a uma menor probabilidade de desenvolver infecções subsequentes com agentes patogénicos multi-resistentes. Um subconjunto de doentes do grupo de tratamento de 8 dias infectados com bacilos não fermentadores gram negativos (por exemplo, Pseudomonas aeruginosa) teve uma maior taxa de recorrência da infecção pulmonar, mas devido à vigilância agressiva, isto não se traduziu num maior risco de mortalidade neste subconjunto de doentes (9).
Em resumo, o tratamento de doentes com suspeita de NP começa com o início imediato dos antibióticos e a recolha das secreções respiratórias. Embora os doentes de baixo risco possam receber uma terapia de espectro mais estreito, a maioria dos doentes necessitará de uma terapia empírica inicial ampla. O regime antibiótico, contudo, deve ser reduzido em 48-72 horas com base em resultados microbiológicos se o paciente estiver a melhorar. A duração global do tratamento de 1 semana é segura e eficaz com menos hipóteses de promover o crescimento de organismos resistentes. No subconjunto de doentes com infecções pseudomonais, o tratamento de 1 semana de duração deve ser seguido de vigilância activa para a recorrência, ou alternativamente, o tratamento pode ser prolongado até duas semanas.
Prognóstico
Inicia-se o tratamento ONCE para NP, a melhoria clínica é normalmente observada em 48-72 horas. Há pouco apoio para seguir quer a resposta microbiológica (eliminação de culturas positivas) quer a resposta por radiografia torácica. A radiografia de tórax fica frequentemente atrasada em relação à resposta clínica, contudo, um CXR marcadamente agravado (>50% de aumento de infiltração) nas primeiras 48 horas pode indicar falha no tratamento. A resolução clínica medida pela temperatura, contagem de glóbulos brancos, e oxigenação ocorre normalmente por 6-7 dias (10). A incapacidade de melhorar a oxigenação em 72 horas mostrou ser preditiva de fracasso do tratamento.
A mortalidade global em doentes com NP chega a 30-70%, em grande parte devido a doença comorbitária grave na população de risco. Taxas de mortalidade mais elevadas são observadas em doentes com PAV e organismos resistentes. A mortalidade atribuível ao episódio de NP é cerca de 30%, e pode ser reduzida para <15% com terapia antibiótica apropriada (1).
Prevenção
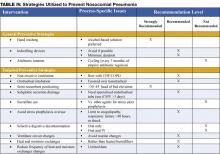
As estratégias preventivas são dirigidas a reduzir a incidência global de complicações infecciosas em pacientes hospitalizados, ou são especificamente dirigidas a reduzir a incidência de pneumonia nosocomial (3). A maioria dos dados que apoiam estratégias preventivas limita-se aos doentes internados na UCI, e em particular aos doentes que recebem ventilação mecânica. No entanto, muitos dos princípios preventivos podem ser extrapolados para a população não UCI. As estratégias preventivas são destacadas na Tabela IV (página 18).
Estratégias Preventivas Gerais
As estratégias preventivas gerais visam evitar a contaminação de doentes com organismos resistentes aos antimicrobianos que existem nos hospitais, ou atenuar o aparecimento de organismos resistentes aos antimicrobianos, em primeiro lugar. A prevenção da propagação iatrogénica de organismos resistentes depende de uma cuidadosa higiene das mãos. A lavagem das mãos antes e depois do contacto com o doente reduz a incidência de infecção nosocomial. Lavagens das mãos à base de álcool colocadas à cabeceira da cama podem na realidade ser superiores ao sabão e à água e, além disso, melhorar o cumprimento da higiene das mãos.
Minimizar a utilização de dispositivos residentes (linhas centrais, cateteres urinários) também reduz o aparecimento de organismos resistentes. Quando estes dispositivos são necessários, é fundamental concentrar-se na sua remoção atempada. O controlo do uso de antibióticos tem sido central em muitas estratégias preventivas. O uso prolongado ou desnecessário de antibióticos de largo espectro está fortemente associado ao desenvolvimento e colonização de organismos resistentes. As estratégias que se concentram na desescalada agressiva dos antibióticos (descrita acima) são uma ferramenta preventiva fundamental. Algumas instituições têm tido sucesso com a restrição ou rotação de antibióticos, mas faltam dados a longo prazo sobre a eficácia destas técnicas.
 clique para versão grande
clique para versão grande
/div>>h3>Estratégias Preventivas Focalizadas
Estratégias preventivas para reduzir a incidência de NP centram-se na redução dos factores de risco de colonização orofaríngea ou gástrica e subsequente aspiração de secreções orofaríngeas ou gástricas contaminadas (1,3,7,11).
Intubação endotraqueal é um dos factores de risco mais importantes para NP em doentes que necessitam de suporte ventilatório. O uso de ventilação não-invasiva (VNI) ou ventilação com máscara de pressão positiva em grupos seleccionados de doentes tem sido eficaz na prevenção da pneumonia nosocomial. A ventilação não-invasiva foi mais bem sucedida em doentes com exacerbações agudas de doença pulmonar obstrutiva crónica (DPOC) e edema pulmonar secundário à insuficiência cardíaca congestiva (ICC) e deve ser considerada em doentes devidamente seleccionados. Quando a intubação é necessária, a utilização da intubação nasotraqueal deve ser evitada devido a taxas mais elevadas de NP quando comparada com a intubação orotraqueal.
O posicionamento superfino pode contribuir para o desenvolvimento do NP, provavelmente devido a um risco acrescido de refluxo gástrico e subsequente aspiração. Estudos de posicionamento semi-recostado (elevação da cabeça do leito >45 graus) mostraram menos refluxo, menos aspiração, e num ensaio recente de controlo aleatório, uma redução significativa na taxa de VAP (12). A elevação da cabeça da cama está claramente indicada em pacientes com ventilação mecânica e é também susceptível de beneficiar todos os pacientes em risco de aspiração e subsequente NP, embora esta técnica não tenha sido bem estudada em pacientes não ventilados.
drenagem de secreção subglótica (SSD) envolve a remoção de secreções agrupadas acima do manguito de um tubo endotraqueal especializado que, de outra forma, poderia vazar para o pulmão. Uma meta-análise de cinco estudos de avaliação desta nova tecnologia mostrou reduções significativas na incidência de PAV. A utilização de SSD deve ser considerada para utilização em doentes que necessitem de mais de 3 dias de ventilação mecânica (13).
Medicamentos utilizados na profilaxia de úlceras de stress que aumentam o pH gástrico – tais como antagonistas de H2 e antiácidos – permitem a colonização do tracto gastrointestinal superior por organismos potencialmente patogénicos e, por conseguinte, aumentam o risco de NP. A utilização de antagonistas de sucralfato em vez de antagonistas de H2 é sentida para levar a uma menor alcalinização do estômago e a um menor crescimento bacteriano excessivo. A capacidade do sucralfato para prevenir a pneumonia nosocomial, no entanto, não foi bem demonstrada e a sua utilização de rotina não é recomendada (14). Em vez disso, os esforços devem ser orientados para limitar a utilização da profilaxia de úlceras de stress a populações com elevado risco de hemorragias clinicamente significativas, nomeadamente doentes com coagulopatia e falha ventilatória prolongada. A maioria dos doentes que não estão na UCI não deve receber profilaxia de úlcera de stress. O risco de NP relacionado com a utilização de inibidores da bomba de protões não foi bem estudado.
Descontaminação digestiva selectiva (SDD) envolve a esterilização da orofaringe e do tracto gastrointestinal em pacientes ventilados mecanicamente, a fim de evitar a aspiração de grandes números de organismos potencialmente patogénicos e subsequente PAV. A maioria das avaliações do SDD envolveram a aplicação oral (e por vezes gástrica) de polimixina tópica, aminoglicosídeo, e anfotericina. Em muitos casos, foram adicionados cursos curtos de antibióticos IV. Pelo menos 10 meta-análises mostraram uma redução do risco de VAP com a utilização de SDD. A adição de antibióticos IV pode também proporcionar um benefício de mortalidade. Contudo, o risco a longo prazo de aparecimento de organismos resistentes, e a insuficiência de dados sobre a relação custo-eficácia dos SDD impedem a sua recomendação para uso rotineiro (14).
Existem várias estratégias preventivas destinadas a reduzir a aspiração de contaminantes nos circuitos de ventilação, filtros, e tubagem. As estratégias recomendadas, listadas na Tabela III, página 16, incluem evitar alterações de rotina nos circuitos de ventilação (mudar a tubagem apenas quando visivelmente contaminada ou para um novo paciente), utilização de permutadores de calor e humidade em vez de humidificadores aquecidos, e redução da frequência das alterações dos permutadores de calor e humidade (1,11,14).
Planos de descarga/acompanhamento
Os doentes devem ser seguidos no hospital até que fique claro que estão a responder à terapia e a melhorar clinicamente. Tem havido uma avaliação limitada das estratégias para uma rápida transição dos pacientes para a terapia oral. Contudo, se os pacientes estão a melhorar, estão a tolerar a terapia oral, têm um tracto gastrointestinal funcional, e têm um organismo isolado que é sensível aos antibióticos orais disponíveis, a mudança para a terapia oral pode ser feita. Se nenhum organismo for isolado, mas um paciente foi definitivamente considerado como tendo NP, os antibióticos orais seleccionados devem ter o mesmo espectro de actividade que os antibióticos IV previamente administrados. Em muitos casos, os doentes terão uma infecção com um organismo que só é susceptível aos antibióticos intravenosos. É provável que estes doentes estejam suficientemente doentes para completar um curso IV completo de uma semana no hospital, mas se não tiverem nenhuma doença co-mórbida activa e tiverem melhorado, podem ter uma linha PICC colocada (ou outro acesso IV de longo prazo) e receber o resto da sua terapia em casa ou noutro ambiente de acuidade inferior.
Em todos os pacientes que desenvolvem NP, devem procurar-se causas reversíveis de aspiração, e nos casos em que organismos multi-resistentes são isolados, isto deve ser comunicado a qualquer instalação para a qual um paciente está a ser transferido ou ao médico de cuidados primários ou enfermeiro domiciliário que assumirá os cuidados após a alta.
- Linhas de orientação para a gestão de adultos com pneumonia hospitalar, associada a ventilador, e associada a cuidados de saúde. Am J Respir Criteria Care Med. 2005;171:388-416.
li>Warren DK, Shukla SJ, Olsen MA, et al. Resultado e custo atribuível da pneumonia associada a ventilação mecânica entre pacientes de unidades de cuidados intensivos num centro médico suburbano. Critérios de Cuidados Médicos. 2003;31:1312-7.li>Flanders SA, Collard HR, Saint S. Preventing Nosocomial Pneumonia. In: Lautenbach E, Woeltje K, eds. The Society for Healthcare Epidemiology of America: Manual Prático para Epidemiologistas dos Cuidados de Saúde. Thorofare, NJ: Slack, 2004:69-78.li>Pugin J, Auckenthaler R, Mili N, Janssens JP, Lew PD, Suter PM. Diagnóstico da pneumonia associada à ventilação por análise bacteriológica de fluido de lavagem broncoalveolar “cego” broncoscópico e não broncoscópico. Am Rev Respir Dis. 1991;143:1121-9.li>Singh N, Rogers P, Atwood CW, Wagener MM, Yu VL. Antibioterapia empírica de curta duração para pacientes com infiltrações pulmonares na unidade de cuidados intensivos. Uma solução proposta para a prescrição indiscriminada de antibióticos. Am J Respir Criteria Care Med. 2000;162:505-11.li>Gibot S, Cravoisy A, Levy B, Bene MC, Faure G, Bollaert PE. Receptor de desencadeamento solúvel expresso em células mielóides e o diagnóstico de pneumonia. N Engl J Med. 2004;350:451-8.li>Chastre J, Fagon JY. Pneumonia associada ao ventilador. Am J Respir Criteria Care Med. 2002;165:867-903.li>Paul M, Benuri-Silbiger I, Soares-Weiser K, Leibovici L. Monoterapia com lactam beta lactam-aminoglicosídeo versus terapia combinada beta lactam-aminoglicosídeo para sepse em doentes imunocompetentes: revisão sistemática e meta-análise de ensaios aleatórios. BMJ. 2004;328:668.li>Chastre J, Wolff M, Fagon JY, et al. Comparação de 8 vs 15 dias de terapia antibiótica para pneumonia associada a ventilação mecânica em adultos: um ensaio aleatório. JAMA. 2003;290:2588-98.li>Dennesen PJ, van der Ven AJ, Kessels AG, Ramsay G, Bonten MJ. Resolução de parâmetros infecciosos após terapia antimicrobiana em doentes com pneumonia associada a ventilação mecânica. Am J Respir Crit Care Med. 2001;163:1371-5.li>Collard HR, Saint S, Matthay MA. Prevention of ventilator-associated pneumonia: an evidence-based systematic review. Ann Intern Med. 2003;138:494-501.li>Drakulovic MB, Torres A, Bauer TT, Nicolas JM, Nogue S, Ferrer M. Posição corporal supina como factor de risco para pneumonia nosocomial em pacientes ventilados mecanicamente: um ensaio aleatório. Lanceta. 1999;354:1851-8.li>Dezfulian C, Shojania K, Collard HR, Kim HM, Matthay MA, Saint S. Subglottic secretion drainage for preventing ventilator-associated pneumonia: uma meta-análise. Am J Med. 2005;118:11-8.li>Dodek P, Keenan S, Cook D, et al. Directriz de prática clínica baseada em evidências para a prevenção da pneumonia associada a ventilação mecânica. Ann Intern Med. 2004;141:305-13.