Stickstoff Element Fakten
Das chemische Element Stickstoff zählt zu den Gasen und Nichtmetallen. Es wurde 1772 von Daniel Rutherford und unabhängig davon von Carl Scheele entdeckt.

Datenbereich
| Klassifizierung: | Stickstoff ist ein Gas und gehört zu den Nichtmetallen |
| Farbe: | farblos |
| Atomgewicht: | 14.0067 |
| Zustand: | Gas |
| Schmelzpunkt: | -210.1 oC, 63.05 K |
| Siedepunkt: | -195.8 oC, 77.4 K |
| Elektronen: | 7 | Protonen: | 7 |
| Neutronen im häufigsten Isotop: | 7 |
| Elektronenschalen: | 2,5 |
| Elektronenkonfiguration: | 1s2 2s2 2p3 |
| Dichte @ 20oC: | 0.0012506 g/cm3 |
Mehr anzeigen, darunter: Wärme, Energien, Oxidation,
Reaktionen, Verbindungen, Radien, Leitfähigkeiten
| Atomvolumen: | 17.3 cm3/mol |
| Struktur: | hcp: hexagonal dicht gepackt |
| Spezifische Wärmekapazität | 1.04 J g-1 K-1 |
| Schmelzwärme | 0,720 kJ mol-1 von N2 |
| Zerstäubungswärme | 473 kJ mol-1 |
| Verdampfungswärme | 5.57 kJ mol-1 von N2 |
| 1. Ionisierungsenergie | 1402.3 kJ mol-1 |
| 2. Ionisierungsenergie | 2856 kJ mol-1 | 3. Ionisierungsenergie | 4578 kJ mol-1 |
| Elektronenaffinität | -6.75 kJ mol-1 |
| Minimale Oxidationszahl | -3 |
| Min. gemeinsame Oxidationsnr. | -3 |
| Maximale Oxidationszahl | 5 |
| Max. gemeinsame Oxidationsnr. | 5 |
| Elektronegativität (Pauling-Skala) | 3,04 |
| Polarisierbarkeit Volumen | 1.1 Å3 |
| Reaktion mit Luft | keine |
| Reaktion mit 15 M HNO3 | keine |
| Reaktion mit 6 M HCl | keine |
| Reaktion mit 6 M NaOH | keine |
| Oxid(e) | N2O, NO, NO2, N2O5 |
| Hydrid(e) | NH3 (Ammoniak), N2H4 (Hydrazin), HN3 (Benzoesäure) |
| Chlorid(e) | NCl3 |
| Atomradius | 65 pm |
| Ionischer Radius (1+ Ion) | – | Ionischer Radius (2+ Ion) | – | Ionischer Radius (3+ Ion) | 30 pm |
| Ionischer Radius (1- Ion) | – |
| Ionenradius (2- Ion) | – | Ionenradius (3- Ion) | – |
| Wärmeleitfähigkeit | 0.02583 W m-1 K-1 |
| Elektrische Leitfähigkeit | – |
| Gefrier-/Schmelzpunkt: | -210,1 oC, 63.05 K |
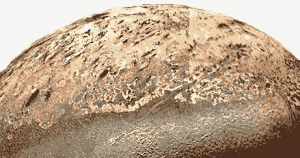
Nasa Image. Tritons Stickstoff-Geysire stoßen schwarze Partikel meilenweit über die Oberfläche. Diese werden von den Winden auf Triton verweht und bilden schwarze Ablagerungen auf der Oberfläche des Satelliten. (Siehe Fakten, unten.)

Flüssiger Stickstoff kondensiert Wasserdampf aus der Umgebungsluft. NASA.
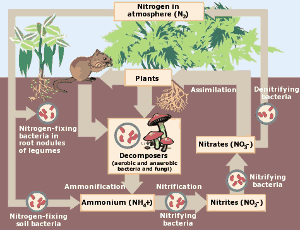
Der Stickstoffzyklus. Klicken Sie hier für ein größeres Bild. (Mit freundlicher Genehmigung der Environmental Protection Agency)
Entdeckung des Stickstoffs
Im Jahr 1674 wies der englische Arzt John Mayow nach, dass Luft kein einzelnes Element ist, sondern sich aus verschiedenen Substanzen zusammensetzt. Er tat dies, indem er zeigte, dass nur ein Teil der Luft brennbar ist. Der größte Teil ist es nicht. (1)
Nahezu ein Jahrhundert später führte der schottische Chemiker Joseph Black genauere Arbeiten an der Luft durch. Nachdem er Sauerstoff und Kohlendioxid entfernt hatte, blieb ein Teil der Luft übrig.
Black verwendete die Verbrennung von Phosphor als letzten Schritt der Sauerstoffentfernung. (Verbrennender Phosphor hat eine sehr hohe Affinität zu Sauerstoff und ist effizient darin, ihn vollständig zu entfernen.) Die weitere Untersuchung der Gase in der Luft übertrug Black dann seinem Doktoranden Daniel Rutherford. (2)
Rutherford baute auf Blacks Arbeit auf und entfernte in einer Reihe von Schritten gründlich Sauerstoff und Kohlendioxid aus der Luft. Er zeigte, dass das zurückbleibende Gas, wie Kohlendioxid, keine Verbrennung oder lebende Organismen unterstützen konnte. Im Gegensatz zu Kohlendioxid war Stickstoff jedoch unlöslich in Wasser und Alkalilösungen. Rutherford berichtete 1772 über seine Entdeckung der „schädlichen Luft“, die wir heute Stickstoff nennen. (3)
Der schwedische Apotheker Carl Scheele entdeckte den Stickstoff unabhängig davon und nannte ihn „verbrauchte Luft“.
Scheele absorbierte den Sauerstoff auf verschiedene Weise, unter anderem mit einer Mischung aus Schwefel und Eisenfeilspänen und durch Verbrennen von Phosphor. Nachdem er den Sauerstoff entfernt hatte, berichtete er von einem Restgas, das keine Verbrennung mehr zuließ und zwischen zwei Drittel und drei Viertel des Volumens der ursprünglichen Luft hatte. Scheele veröffentlichte seine Ergebnisse im Jahr 1777, obwohl man annimmt, dass die Arbeit bereits 1772 durchgeführt wurde. (4)
Obwohl Rutherford und Scheele nun gemeinsam die Entdeckung des Stickstoffs zugeschrieben wird, scheint er schon früher von Henry Cavendish entdeckt, aber nicht veröffentlicht worden zu sein.
Vor 1772 (das genaue Datum ist unbekannt – Priestley bezieht sich darauf in seinem Werk „Experiments and Observations Made in and Before the Year 1772“) schrieb Cavendish an Joseph Priestley und beschrieb die „verbrannte Luft“.
Die „verbrannte Luft“ wurde hergestellt, indem Luft wiederholt über glühende Holzkohle geleitet wurde (wodurch der Sauerstoff entfernt wurde) und dann das verbleibende Gas durch eine Kalilauge (Kaliumhydroxid) geblasen wurde, wodurch das Kohlendioxid entfernt wurde.
Cavendish schrieb: „Es wurde festgestellt, dass sich das spezifische Gewicht dieser Luft sehr wenig von dem der gewöhnlichen Luft unterscheidet; von den beiden schien sie eher leichter zu sein. Sie löschte die Flamme und machte gewöhnliche Luft untauglich, um Körper auf dieselbe Weise wie feste Luft zum Brennen zu bringen, aber in einem geringeren Grad, denn eine Kerze, die in reiner gewöhnlicher Luft etwa 80″ brannte und in gewöhnlicher Luft, die mit 6/55 fester Luft gemischt war, sofort erlosch, brannte in gewöhnlicher Luft, die mit demselben Anteil dieser verbrannten Luft gemischt war, etwa 26″.“ (5)
Im Jahr 1790 benannte der französische Chemiker Jean-Antoine-Claude Chaptal das Element „Stickstoff“, nachdem Experimente gezeigt hatten, dass es ein Bestandteil von Salpeter, wie Kaliumnitrat damals genannt wurde, ist.
Interessante Fakten über Stickstoff
- Ungefähr 2,5 Prozent des Gewichts lebender Organismen stammen von Stickstoff in organischen Molekülen.
- Viele der Moleküle des Lebens enthalten Stickstoff. Es ist das vierthäufigste Element im menschlichen Körper.
- Die Stickstoffverbindung Nitroglycerin kann zur Linderung von Angina pectoris, einer lebensbedrohlichen Herzerkrankung, eingesetzt werden.
- Neptuns Trabant Triton hat fünf Meilen hohe, von Stickstoff betriebene Geysire.
Wie die Erde besteht auch Tritons Atmosphäre hauptsächlich aus Stickstoff, aber Triton ist so kalt, dass der Stickstoff als steinharter Feststoff auf der Oberfläche sitzt. Der feste Stickstoff lässt das schwache Licht, das von der Sonne kommt, hindurch. Dunkle Verunreinigungen im Stickstoff-Eis oder in dunkleren Gesteinen unter dem Eis erwärmen sich leicht im Sonnenlicht, schmelzen und verdampfen den festen Stickstoff, der schließlich in Form von Geysiren den festen Stickstoff durchbricht und Eispartikel ein bis fünf Meilen über die gefrorene Oberfläche von Triton schiebt. - Stickstoff ist das siebthäufigste Element im Universum.
- Im Jahr 1919 erfuhr die Welt zum ersten Mal, dass Atomkerne zerfallen können. Ernest Rutherford berichtete, dass er Stickstoffgas mit Alpha-Teilchen (Heliumkerne) beschossen hatte und feststellte, dass dabei Wasserstoff entstand. (Weitere Forschungen von Patrick Blackett zeigten, dass die Alphateilchen Stickstoff-14 in Sauerstoff-17 plus Wasserstoff umgewandelt hatten.)
- Der Stickstoff des Universums wurde und wird durch den CNO-Zyklus in Sternen, die schwerer als unsere Sonne sind, hergestellt. (Siehe Bild unten)
Stickstoff und der CNO-Zyklus
Als die erste Generation von Sternen im Universum geboren wurde, enthielten sie nur die Elemente, die beim Urknall entstanden sind: Wasserstoff, Helium und eine winzige Menge Lithium.
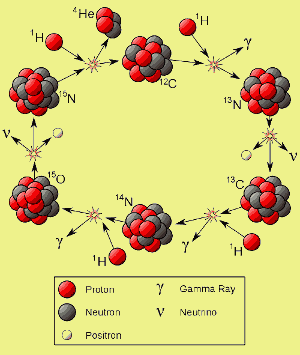
Klicken Sie hier für eine Vergrößerung. Image by Borb.
Als diese Sterne verbrannten, synthetisierten sie schwerere Elemente, wie zum Beispiel Kohlenstoff. Supernovae verteilten dann die schwereren Elemente in Galaxien, wo weitere Sterne geboren wurden.
Kohlenstoff aus Supernovae spielt eine entscheidende Rolle bei der Art und Weise, wie viele Sterne der zweiten und höheren Generation brennen. In Sternen, deren Masse höher ist als etwa das 1,1- bis 1,5-fache unserer Sonne, katalysiert Kohlenstoff-12 die Fusion von Wasserstoff zu Helium – d.h. Kohlenstoff-12 nimmt an der Fusionsreaktion teil, wird aber nicht von ihr verbraucht.
Wie Sie links sehen können, wird Kohlenstoff-12 am Ende jedes Zyklus regeneriert, so dass unter dem Strich vier Wasserstoffkerne verbraucht und ein Heliumkern erzeugt wird. Diese Reaktion wird als CNO-Zyklus bezeichnet.
Mit der Zeit kann jeder Kohlenstoff-12-Kern an einer sehr großen Anzahl von Zyklen teilnehmen. Ein Teil des Stickstoffs, der während des CNO-Zyklus entsteht, entzieht sich einer weiteren Reaktion. Am Ende des Lebens eines Sterns kann dieser Stickstoff in der Galaxie verteilt werden. In unserem Sonnensystem endete der Stickstoff eines vor Milliarden von Jahren erloschenen Sterns als essenzielles Element in Proteinen und DNA und bildete etwa 80 Prozent der Atmosphäre unseres Planeten.

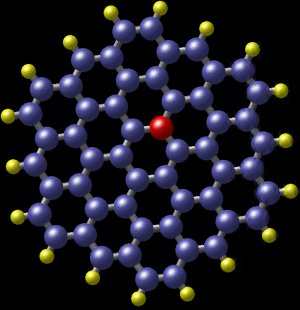
Ein polyzyklischer aromatischer Kohlenwasserstoff mit Stickstoff. Die blauen Kugeln sind Kohlenstoffatome und die gelben Kugeln sind Wasserstoffatome. Die rote Kugel zeigt die Position eines Stickstoffatoms, das fast perfekt in das Molekül passt. Dieses Molekül wurde in der Spiralgalaxie M81 entdeckt, etwa 12 Millionen Lichtjahre von der Erde entfernt. (Bild: Nasa)
Erscheinungsbild und Eigenschaften
Schädliche Auswirkungen:
Stickstoff ist unter normalen Bedingungen ungiftig.
Der direkte Hautkontakt mit flüssigem Stickstoff verursacht schwere Erfrierungen.
Dekompression bei Tauchern oder Astronauten kann die „Kurve“ verursachen – ein potenziell tödlicher Zustand, wenn sich Stickstoffblasen im Blutkreislauf bilden.
Eigenschaften:
Stickstoff ist ein farbloses, geruchloses, geschmackloses, zweiatomiges und im Allgemeinen inertes Gas bei Standardtemperatur und -druck.
Bei Atmosphärendruck ist Stickstoff zwischen 63 K und 77 K flüssig.
Flüssigkeiten, die kälter sind als diese, sind wesentlich teurer in der Herstellung als flüssiger Stickstoff.
Verwendungen von Stickstoff
Stickstoff wird zur Herstellung von Ammoniak (Haber-Verfahren) und Düngemitteln verwendet, die für die heutigen Methoden der Lebensmittelproduktion unerlässlich sind. Außerdem wird er zur Herstellung von Salpetersäure verwendet (Ostwald-Verfahren).
Beim Enhanced Oil Recovery wird Stickstoff unter hohem Druck eingesetzt, um Rohöl, das sonst nicht gefördert werden könnte, aus den Ölquellen zu drücken. Die inerten Eigenschaften von Stickstoff werden in der Chemie- und Erdölindustrie genutzt, um Lagertanks mit einer inerten Gasschicht zu überziehen.
Flüssiger Stickstoff wird als Kältemittel eingesetzt. Supraleiter für praktische Technologien sollten idealerweise bei Temperaturen oberhalb von 63 K keinen elektrischen Widerstand aufweisen, da diese Temperatur mit flüssigem Stickstoff relativ kostengünstig zu erreichen ist. Niedrigere Temperaturen sind deutlich teurer.
Während elementarer Stickstoff nicht sehr reaktiv ist, sind viele Verbindungen des Stickstoffs instabil.
Beim Schweißen bilden sich im Stahl natürlich Oxide, die die Schweißnaht schwächen. Stickstoff kann verwendet werden, um Sauerstoff während des Schweißens auszuschließen, was zu besseren Schweißnähten führt.
In der natürlichen Welt ist der Stickstoffkreislauf von entscheidender Bedeutung für lebende Organismen. Stickstoff wird der Atmosphäre entnommen und durch Gewitter und stickstofffixierende Bakterien in Nitrate umgewandelt. Die Nitrate düngen das Pflanzenwachstum, wo der Stickstoff in Aminosäuren, DNA und Proteinen gebunden wird. Er kann dann von Tieren gefressen werden. Schließlich kehrt der Stickstoff von den Pflanzen und Tieren in den Boden und die Atmosphäre zurück und der Kreislauf wiederholt sich.
Häufigkeit und Isotope
Häufigkeit Erdkruste: 19 Teile pro Million nach Gewicht, 28 Teile pro Million nach Mol
Häufigkeit Sonnensystem: 1.000 ppm nach Gewicht, 90 ppm nach Mol
Kosten, rein: $0,4 pro 100g
Kosten, lose: $ pro 100g
Quelle: Kommerziell wird Stickstoff durch fraktionierte Destillation aus flüssiger Luft gewonnen. Die Erdatmosphäre enthält etwa 4 Quadrillionen Tonnen (4 x 1015) Stickstoff.
Isotope: Stickstoff hat 12 Isotope, deren Halbwertszeiten bekannt sind, mit den Massenzahlen 11 bis 19. Natürlich vorkommender Stickstoff ist ein Gemisch aus zwei Isotopen, 14N und 15N mit natürlichen Häufigkeiten von 99,6 % bzw. 0,4 %.

- Alexander Findlay, Chemistry in the Service of Man., (2007) p46. Findlay Press.
- Aaron John Ihde, The Development of Modern Chemistry., (2007) p38. Dover Publications.
- Jonathan Shectman, Groundbreaking Scientific Experiments, Inventions, and Discoveries of the 18th Century., (2003) p78. Greenwood Publishing Group.
- Ida Freund, The Experimental Basis Of Chemistry – Suggestions For A Series Of Experiments Illustrative Of The Fundamental Principles Of Chemistry., (2007) p145. Caffin Press.
- George Wilson, The Life of Henry Cavendish, (1851) p28. The Cavendish Society. (pdf – großer Download 31 MB).
- Royston M. Roberts, Serendipity, Accidental Discoveries in Science., (1989) p89. John Wiley and Sons.
Diese Seite zitieren
Für die Online-Verknüpfung kopieren Sie bitte eine der folgenden Angaben und fügen sie ein:
<a href="https://www.chemicool.com/elements/nitrogen.html">Nitrogen</a>
oder
<a href="https://www.chemicool.com/elements/nitrogen.html">Nitrogen Element Facts</a>
Um diese Seite in einem akademischen Dokument zu zitieren, verwenden Sie bitte die folgende MLA-konforme Zitation:
"Nitrogen." Chemicool Periodic Table. Chemicool.com. 08 Oct. 2012. Web. <https://www.chemicool.com/elements/nitrogen.html>.