BMRB Featured System: Lysozym
Lysozym (1,4-β-N-Acetylmuramidase) ist ein Enzym, das eine wichtige Rolle bei der Prävention von bakteriellen Infektionen spielt. Es tut dies, indem es einen spezifischen Bestandteil bestimmter bakterieller Zellwände, das Peptidoglykan, angreift. Peptidoglykan besteht aus den sich wiederholenden Aminozuckern N-Acetylglucosamin (NAG) und N-Acetylmuraminsäure (NAM), die durch Peptidbrücken vernetzt sind. Lysozym wirkt, indem es die Bindung zwischen NAG undNAM hydrolysiert, die Permeabilität des Bakteriums erhöht und die Bakterien zum Platzen bringt.
Lysozym ist in Pflanzen und Tieren weit verbreitet. Beim Menschen wird Lysozym in den Schleimhäuten der Nasenhöhle und der Tränenkanäle exprimiert. Es findet sich auch in Speichel, Tränen, Milch, Zervixschleim, Leukozyten und Nierengewebe. Der Großteil des in der Forschung verwendeten Lysozyms wird aus Hühnereiweiß gereinigt.
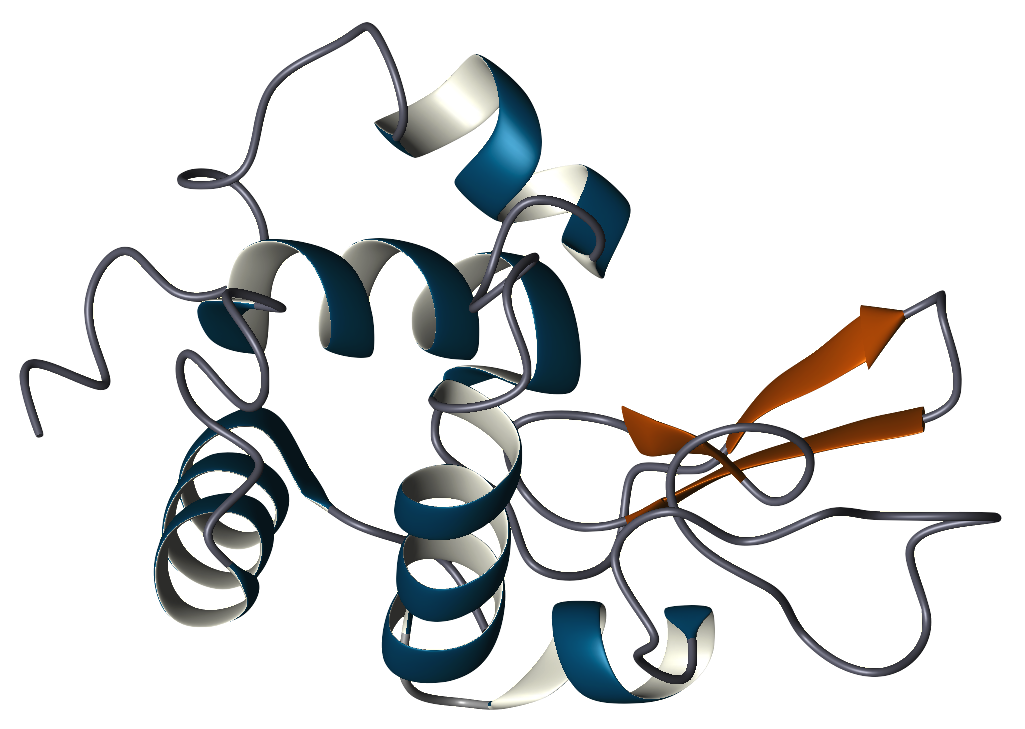
Die Primärstruktur von Lysozym ist ein einzelnes Polypeptid mit 129 Aminosäuren. Unter physiologischen Bedingungen ist Lysozym zu einer kompakten, kugelförmigen Struktur mit einem langen Spalt in der Proteinoberfläche gefaltet. Diese Spalte ist die aktive Stelle, die an die bakterielle Kohlenhydratkette bindet und diese anschließend spaltet.
Lysozym wurde 1921 von Alexander Fleming entdeckt, als er nachwies, dass sein eigener Nasenschleim die Fähigkeit hatte, das Wachstum eines bestimmten Bakterienstamms in einer Kultur zu hemmen. Er erkannte, dass dies größtenteils auf die Wirkung eines Proteins im Schleim zurückzuführen war, das die Bakterienzellen zum Lysieren oder Auseinanderbrechen brachte. Daher nannte er das Protein Lysozym. In einer Publikation aus dem Jahr 1922 berichtete er über seine Aktivität in Hühnereiweiß, Tränen, Speichel, Sputum und Nasensekret. In einer nachfolgenden Studie wies Fleming in Zusammenarbeit mit V. D. Allison Lysozym in menschlichem Blutserum, Speichel, Milch und einer Vielzahl anderer Flüssigkeiten nach.
Trotz der antimikrobiellen Aktivität von Lysozym gegenüber harmlosen, durch die Luft übertragenen Bakterien, erwies es sich als unwirksam gegenüber krankheitsverursachenden Bakterien. Fleming erkannte, dass es keine breite medizinische Anwendung für seine Entdeckung gab und wandte sich anderen Studien über chemische Antiseptika zu. Seine Arbeit an Lysozym förderte jedoch Flemings Interesse an antimikrobiellen Wirkstoffen und führte 1928 zur Entdeckung von Penicillin, für das er 1945 den Nobelpreis erhielt.
Im Jahr 1966 bestimmte David Chilton Phillips mit Hilfe der Röntgenkristallographie die Struktur von Lysozym, die erste, die für ein Enzym gefunden wurde. Mit dieser Arbeit konnte Phillips den Mechanismus der katalytischen Aktivität des Enzyms erklären. Lysozym ist heute eine der am häufigsten vorkommenden Proteinstrukturen in der Protein Data Bank.
Lysozym wurde im September 2000 zum Molekül des Monats der Protein Data Bank gewählt. Diese Seite bietet zusätzliche Informationen zu verschiedenen Lysozym-bezogenen Themen, einschließlich Geschichte, Struktur und Funktion.