BMRB Sistema em Destaque: Lysozyme
Lysozyme (1,4-β-N-acetylmuramidase) é uma enzima que desempenha um papel importante na prevenção de infecções bacterianas. Faz isto atacando um componente específico de certas paredes celulares bacterianas,peptidoglicano. O peptidoglicano é composto pelos aminoácidos repetitivos, N-acetilglucosamina (NAG) e ácido N-acetilmurâmico (NAM), reticulado por pontes de peptídeo. A lisozima actua hidrolisando a ligação entre NAG eNAM, aumentando a permeabilidade da bactéria e provocando a sua explosão.
Lisozima está amplamente distribuída em plantas e animais. A lisozima humana é expressa nas membranas mucosas da cavidade tenasal e dos canais lacrimais. É também encontrada na saliva, lágrimas, leite, muco cervical, leucócitos, e rim. A maioria da lisozima utilizada na investigação é purificada a partir de claras de ovos de galinha.
br>
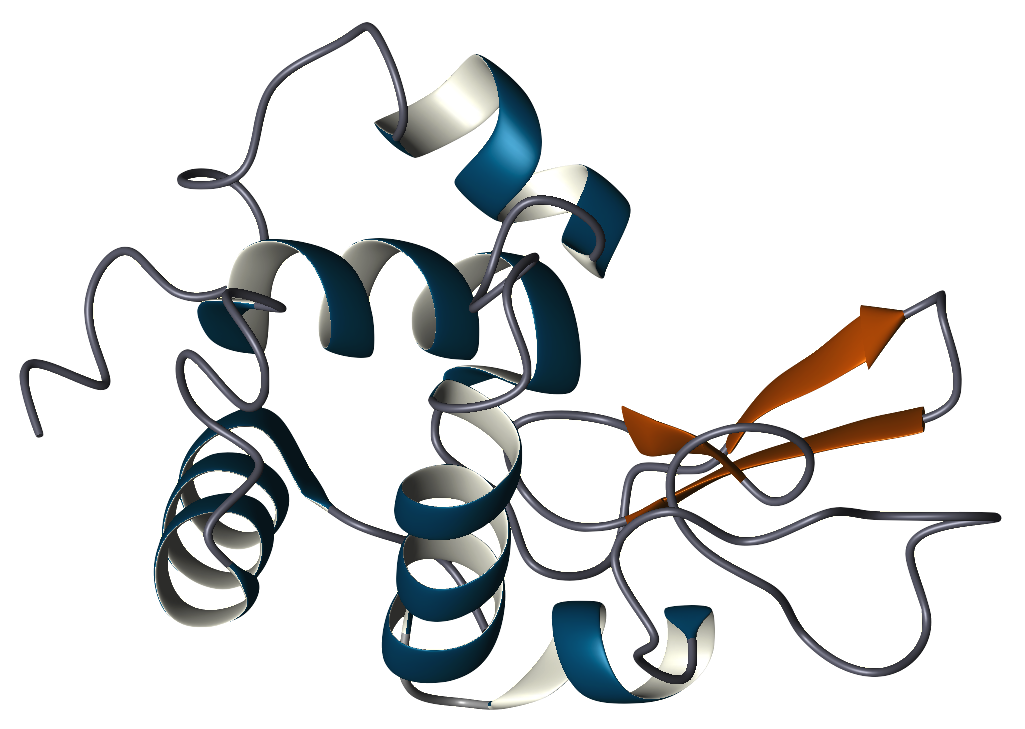
p> A estrutura primária da lisozima é um único polipeptídio contendo 129 aminoácidos. Em condições fisiológicas, a lisozima é dobrada numa estrutura compacta, globular, com uma longa fenda na superfície da proteína. Esta fenda é o local activo envolvido na ligação à cadeia bacteriana de hidratos de carbono e, subsequentemente, na sua clivagem.
Lisozima foi descoberta por Alexander Fleming em 1921 quando demonstrou que o seu próprio muco nasal tinha a capacidade de inibir o crescimento de uma determinada estirpe de bactérias em cultura. Ele percebeu que isto se devia em grande parte à acção de uma proteína dentro do muco que fazia com que as células bacterianas mentissem ou se partissem. Daí o nome da lisozima da proteína. Numa publicação de 1922, relatou a sua actividade na clara do ovo das galinhas, lágrimas, saliva, expectoração e secreções nasais. Num estudo subsequente, Fleming em colaboração com V. D. Allison detectou lisozima em soro de sangue humano, saliva, leite, e uma grande variedade de outros fluidos.
Embora a actividade antimicrobiana da lisozima para bactérias inofensivas, transportadas pelo ar, provou ser ineficaz contra bactérias causadoras de doenças. Fleming, apercebendo-se de que não havia aplicações médicas amplas para a sua descoberta, avançou para outros estudos em anti-sépticos químicos. Contudo, o seu trabalho sobre lisozima estimulou ainda mais o interesse de Fleming por agentes antimicrobianos e, consequentemente, levou à descoberta da penicilina em 1928, pela qual recebeu mais tarde um Prémio Nobel em 1945.
Em 1966, David Chilton Phillips, utilizando cristalografia de raios X, determinou a estrutura da lisozima, o primeiro eversolvido para uma enzima. A partir deste trabalho, Phillips foi capaz de explicar o mecanismo da actividade catalítica da enzima. A lisozima é agora uma das estruturas proteicas mais abundantes no Banco de Dados de Proteínas.
Lisozima foi seleccionada como a molécula do Mês do Banco de Dados de Proteínas em Setembro de 2000. Esta página oferece informação adicional sobre vários tópicos relacionados com lisozima, incluindo história, estrutura, e função.