Sistema BMRB in primo piano: Lisozima
Il lisozima (1,4-β-N-acetilmuramidasi) è un enzima che gioca un ruolo importante nella prevenzione delle infezioni batteriche. Lo fa attaccando un componente specifico di alcune pareti cellulari batteriche, il peptidoglicano. Il peptidoglicano è composto da amino zuccheri ripetuti, N-acetilglucosamina (NAG) e acido N-acetilmuramico (NAM), reticolati da ponti peptidici. Il lisozima agisce idrolizzando il legame tra NAG e NAM, aumentando la permeabilità dei batteri e causandone lo scoppio.
Il lisozima è ampiamente distribuito nelle piante e negli animali. Il lisozima umano è espresso nelle membrane mucose della cavità nasale e nei condotti lacrimali. Si trova anche nella saliva, nelle lacrime, nel latte, nel muco cervicale, nei leucociti e nel tessuto renale. La maggior parte del lisozima usato nella ricerca è purificato dall’albume d’uovo di gallina.
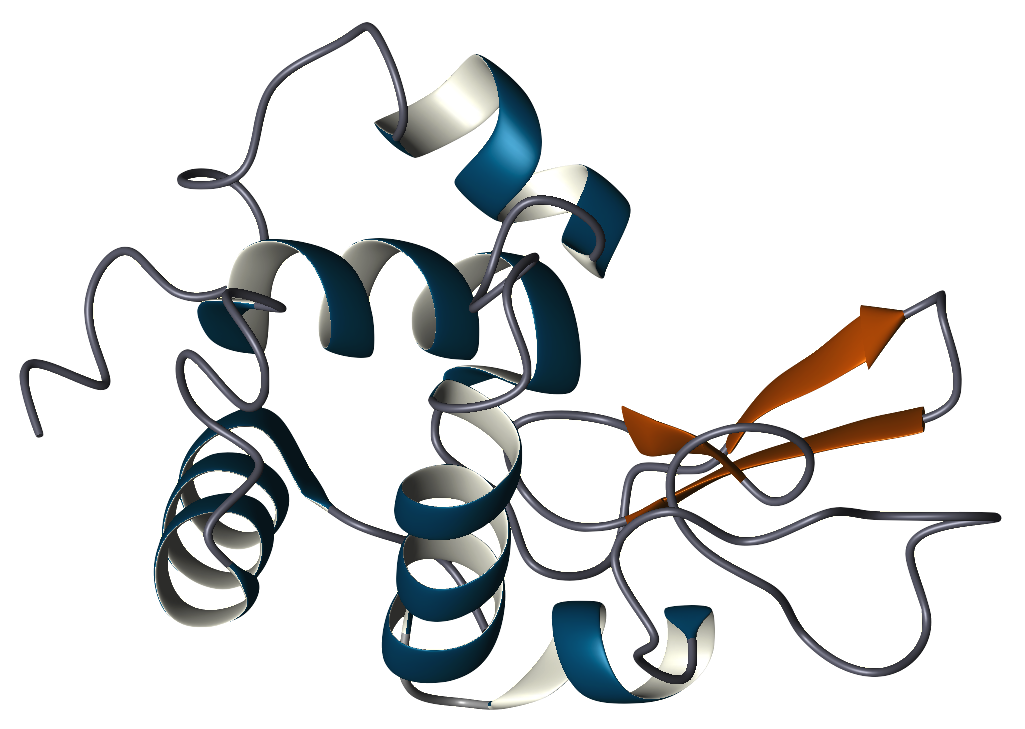
La struttura primaria del lisozima è un singolo polipeptide contenente 129 aminoacidi. In condizioni fisiologiche, il lisozima è ripiegato in una struttura compatta e globulare con una lunga fessura sulla superficie della proteina. Questa fessura è il sito attivo coinvolto nel legame con la catena di carboidrati batterica e nella successiva scissione.
Il lisozima fu scoperto da Alexander Fleming nel 1921 quando dimostrò che il suo muco nasale aveva la capacità di inibire la crescita di un certo ceppo di batteri in cultura. Si rese conto che questo era in gran parte dovuto all’azione di una proteina all’interno del muco che causava la lisi delle cellule batteriche o la loro rottura. Quindi, chiamò la proteina lisozima. In una pubblicazione del 1922, riportò la sua attività in albume d’uovo di gallina, lacrime, saliva, espettorato e secrezioni nasali. In uno studio successivo, Fleming in collaborazione con V. D. Allison rilevò il lisozima nel siero del sangue umano, nella saliva, nel latte e in un’ampia varietà di altri fluidi. Fleming, rendendosi conto che non c’erano ampie applicazioni mediche alla sua scoperta, passò ad altri studi sugli antisettici chimici. Tuttavia, il suo lavoro sul lisozima stimolò ulteriormente l’interesse di Fleming per gli agenti antimicrobici e di conseguenza portò alla scoperta della penicillina nel 1928, per la quale poi ricevette un premio Nobel nel 1945.
Nel 1966, David Chilton Phillips, usando la cristallografia a raggi X, determinò la struttura del lisozima, la prima eversoluta per un enzima. Da questo lavoro, Phillips fu in grado di spiegare il meccanismo dell’attività catalitica dell’enzima. Il lisozima è ora una delle strutture proteiche più abbondanti nella Protein Data Bank.
Il lisozima è stato selezionato come molecola del mese della Protein Data Bank nel settembre del 2000. Questa pagina offre ulteriori informazioni su vari argomenti relativi al lisozima, tra cui storia, struttura e funzione.