Bacteria Mycobacterium tuberculosis
Mycobacterium tuberculosis
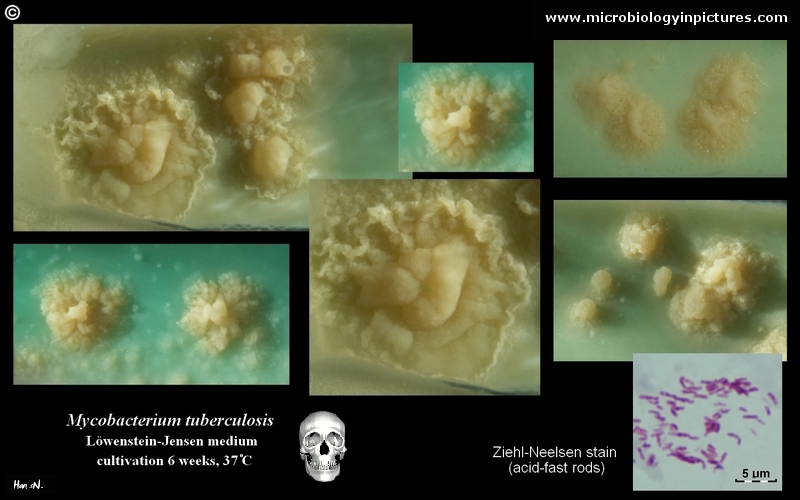

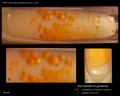
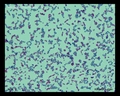
Mycobacterium tuberculosis en medio Löwenstein-Jensen tras 6 semanas de cultivo, 37°C. Típicas colonias no pigmentadas, ásperas y secas en medio Löwenstein-Jensen. El color verde del medio se debe a la presencia de verde de malaquita, que es uno de los agentes selectivos para impedir el crecimiento de la mayoría de los demás contaminantes. A diferencia de muchos otros medios de cultivo sólidos utilizados en microbiología clínica, el medio de Löwenstein-Jensen (o, por ejemplo, el medio de Ogawa) no contiene agar (la consistencia sólida se consigue mediante la coagulación por calor de la albúmina de huevo).
Mycobacterium tuberculosis (MTB) es una especie bacteriana patógena del género Mycobacterium y el agente causante de la mayoría de los casos de tuberculosis. Descubierta por primera vez en 1882 por Robert Koch, M. tuberculosis tiene una capa cerosa inusual en la superficie de la célula (principalmente ácido micólico), que hace que las células sean impermeables a la tinción de Gram; en su lugar se utilizan técnicas de prueba de ácido. La fisiología de M. tuberculosis es altamente aeróbica y requiere altos niveles de oxígeno. Principalmente es un patógeno del sistema respiratorio de los mamíferos, el MTB infecta los pulmones, causando tuberculosis.
M. tuberculosis requiere oxígeno para crecer. No retiene ninguna tinción bacteriológica común debido al alto contenido en lípidos de su pared, por lo que no es ni Gram-positiva ni Gram-negativa; de ahí que se utilice la tinción de Ziehl-Neelsen, o tinción de resistencia al ácido. Aunque las micobacterias no parecen encajar en la categoría de Gram positivas desde un punto de vista empírico (es decir, no retienen la tinción de violeta de cristal), se clasifican como bacterias Gram positivas resistentes al ácido debido a su falta de membrana celular externa.
M. tuberculosis se divide cada 15-20 horas, lo que es extremadamente lento en comparación con otras bacterias, que suelen tener tiempos de división medidos en minutos (Escherichia coli puede dividirse aproximadamente cada 20 minutos). Su inusual pared celular, rica en lípidos (por ejemplo, ácido micólico), es probablemente responsable de esta resistencia y es un factor de virulencia clave.Cuando está en los pulmones, M. tuberculosis es captada por los macrófagos alveolares, pero éstos son incapaces de digerir la bacteria. Su pared celular impide la fusión del fagosoma con un lisosoma. En concreto, M. tuberculosis bloquea la molécula puente, el autoantígeno endosomal temprano 1 (EEA1); sin embargo, este bloqueo no impide la fusión de las vesículas llenas de nutrientes. En consecuencia, las bacterias se multiplican sin control dentro del macrófago.
Cultivo
M. tuberculosis se cultiva en un medio selectivo conocido como medio Löwenstein-Jensen, que se ha utilizado tradicionalmente para este fin. Sin embargo, este método es bastante lento, ya que este organismo necesita entre 6 y 8 semanas para crecer (crecimiento de las colonias aisladas en más de 7 días), lo que retrasa la comunicación de los resultados. Actualmente se puede obtener un resultado más rápido utilizando el medio Middlebrook o BACTEC.
Abstracción de Wikipedia
Características básicas de Mycobacterium tuberculosis
- BASTOS ÁCIDOS
- NO MÓVILES
- No formadores de esporas
- CATALASA: POSITIVO**
- OXIDASA: NEGATIVO
- AEROBES
** algunas cepas de M.tuberculosis pueden ser negativas
Identificación de Mycobacterium tuberculosis
- Micobacterias de crecimiento lento (crecimiento de las colonias aisladas en más de 7 días)
- No pigmentadas, colonias ásperas y secas en el medio Löwenstein-Jensen
- Acid-fast (tinción de Ziehl-Neelsen o Kinyoun)
- No fotocromático
- La prueba de la niacina: positiva
- La prueba de reducción de nitratos: positiva
- Crecimiento en TCH (hidrazida de ácido tiofeno-2-carboxílico); 10µg/ml: positiva, resistente a TCH (a diferencia de M.bovis)
- Crecimiento en agar pirazinamidasa (PZA); 25µg/ml: negativo
- La prueba de la arilsulfatasa (prueba de los 3 días): negativa
- ¡Siempre deben realizarse pruebas de susceptibilidad al menos para INH, RIF y EMB!!! ¡¡Los fármacos no se utilizan por separado!! (¿Por qué?)
- Fármacos de primera línea
- Isoniazida (INH)
- Etambutol (EMB)
- Pirazinamida (PZA)
- Rifampicina (Rifampin) (RMP/RIF)
- Estreptomicina** (SM/STM)
- amikacina (aminoglucósidos)
- kanamicina (aminoglucósidos)
- ciprofloxacina (quinolonas)
- cicloserina
- Para ver más visite Wikipedia
- Lista de antibióticos (Wikipedia)
- Mycobacterium spp.
- Mycobacterium tuberculosis
- Tuberculosis
- Vacunación
- Datos básicos sobre la tuberculosis
- Pruebas & Diagnóstico
- Pruebas de tuberculosis (TB)
- Tratamiento de la tuberculosis; Sociedad Torácica Americana, CDC, y Sociedad de Enfermedades Infecciosas de América
** Sólo en los Estados Unidos, la estreptomicina ya no se considera un medicamento de primera línea por la ATS/IDSA/CDC debido a las altas tasas de resistencia.
Fármacos de segunda líneamedicamentos de segunda línea (ejemplos)
Los medicamentos de segunda línea sólo se utilizan para tratar la enfermedad que es resistente a la terapia de primera líneaEl tratamiento estándar de «corta duración» para la tuberculosis es la isoniazida (junto con el fosfato de piridoxal para obviar la neuropatía periférica causada por la isoniazida), rifampicina (rifampin en los Estados Unidos), pirazinamida y etambutol durante dos meses, y luego isoniazida y rifampicina solos durante otros cuatro meses. Se considera que el paciente está libre de bacterias vivas después de seis meses (aunque sigue habiendo una tasa de recaída de hasta el 7%).
Mycobacterium tuberculosis en medio Löwenstein-Jensen




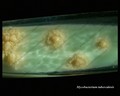



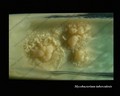


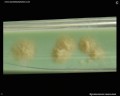


Cultivo de Mycobacterium tuberculosis


Mycobacterium sp.


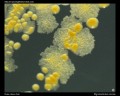


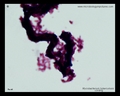
Tinción ácido-resistente (Ziehl-Neelsen & tinción de Kinyoun)


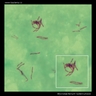



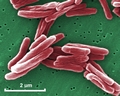
Mycobacterium tuberculosis SEM & Ilustraciones 3D
Enlaces útiles
WIKIPEDIA
- CENTROS PARA EL CONTROL Y LA PREVENCIÓN DE ENFERMEDADES (CDC)
Biblioteca de Microscopía
Tratamiento de Mycobacterium tuberculosis
Tinción ácido-rápida